载脂蛋白与疾病(APOA1)
- boke
- 2024-06-04
- 4:54 下午
血脂是血清中的胆固醇、甘油三酯(Triglyceride,TG)和类脂(如磷脂)等的总称,与临床密切相关的血脂主要是胆固醇和 TG。由于血脂不溶于水,因此必须与特殊的蛋白质,即载脂蛋白(apoprotein,Apo),结合形成脂蛋白才能溶于血液,并被运输至组织进行代谢[1]。
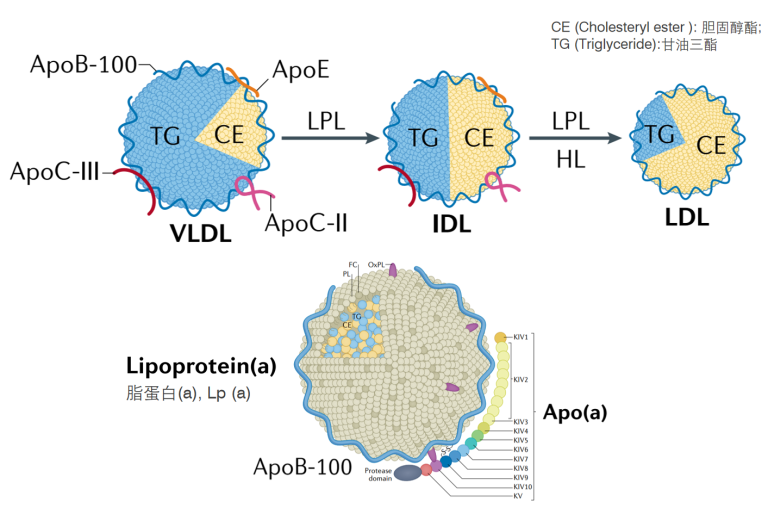
不同脂蛋白结合的载脂蛋白[2]
按照脂蛋白进行分类,包括乳糜微粒(chylomicron,CM)、极低密度脂蛋白(very low-density lipoprotein,VLDL)、中间密度脂蛋白(intermediate-density lipoprotein,IDL)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)和 脂蛋白(a)[ Lipoprotein(a), Lp(a)]。
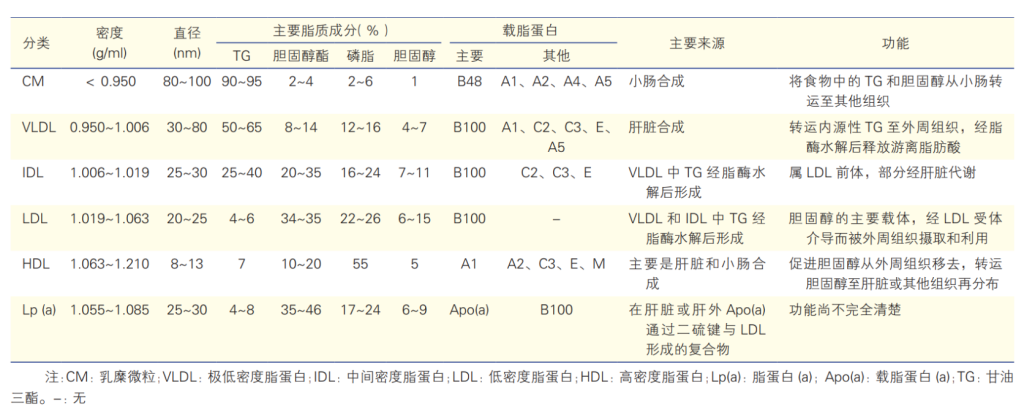
脂蛋白的物理及生物学特性和功能[1]
按照载脂蛋白进行分类,包括载脂蛋白B-100 (ApoB-100)、载脂蛋白B-48 (ApoB-48)、载脂蛋白A-I (ApoA-I)、载脂蛋白C-II (ApoC-II)、载脂蛋白C-III (ApoC-III)、载脂蛋白E (ApoE)、以及载脂蛋白(a)[Apo(a)]等。
不同的脂蛋白,其结合的载脂蛋白种类会存在差异。例如,极低密度脂蛋白(VLDL)除结合载脂蛋白ApoB-100外,还包括ApoC-II、ApoC-III和ApoE等载脂蛋白;低密度脂蛋白(LDL)由VLDL转化而来,但LDL中的载脂蛋白95% 以上为ApoB-100,而脂蛋白(a)[Lipoprotein(a), Lp(a)]则包括Apo-B100和Apo(a)两种载脂蛋白。载脂蛋白在人体胆固醇稳态中发挥着重要作用,一旦发生功能变异,则会导致严重的疾病。
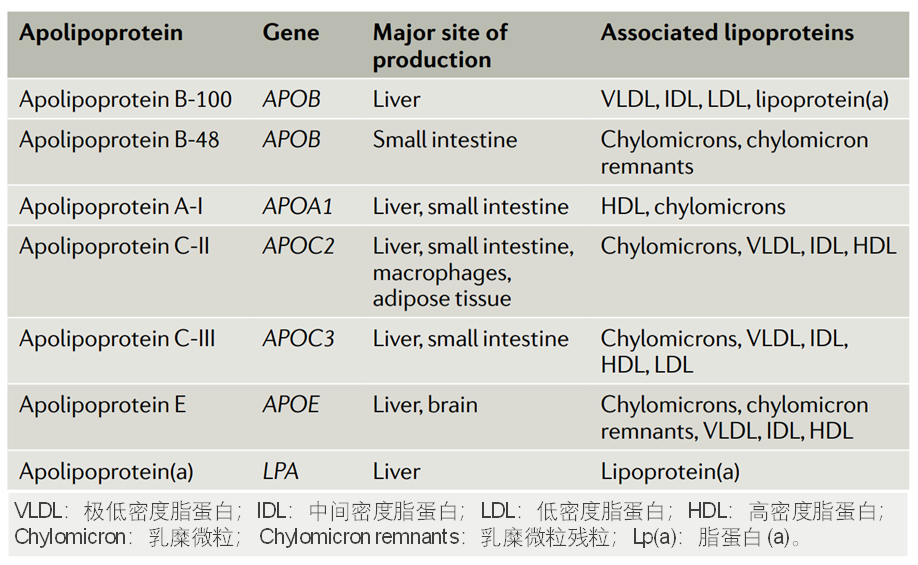
载脂蛋白的编码基因、合成组织和相关的脂蛋白[2]
高密度脂蛋白(HDL)
HDL主要由肝脏和小肠合成,为颗粒最小的脂蛋白。HDL通过胆固醇的逆向转运作用(RCT)过程促进巨噬细胞、平滑肌细胞和动脉壁的内皮细胞中胆固醇流出并转运至肝脏以进行最终排泄。因此,HDL有助于从细胞、组织和血管的斑块中清除多余的胆固醇,也被称为“血管清道夫”。
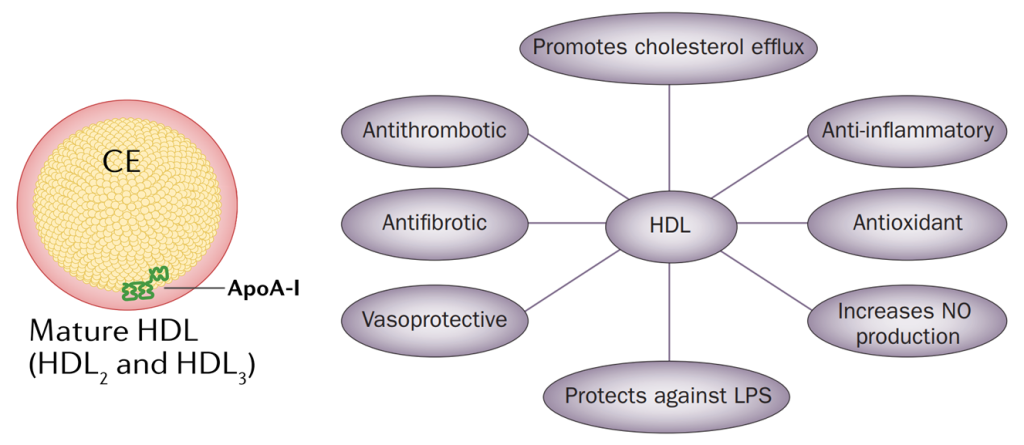
HDL的结构及功能特性。HDL的重要功能包括逆转胆固醇转运和胆固醇流出,以及它在抗炎过程中的作用[2、3]
除了RCT作用外,HDL还具有抗氧化、抗炎以及抗血栓的功能,上个世纪70-80年代的研究显示,血清HDL-C 水平与ASCVD 发病风险呈负相关,HDL被赋予了“好胆固醇”的称号。但近年的研究表明,HDL与心脑血管疾病的关系并不是简单的线性负相关,而是呈现U型关联,因此也需要谨慎对待HDL过高的现象。
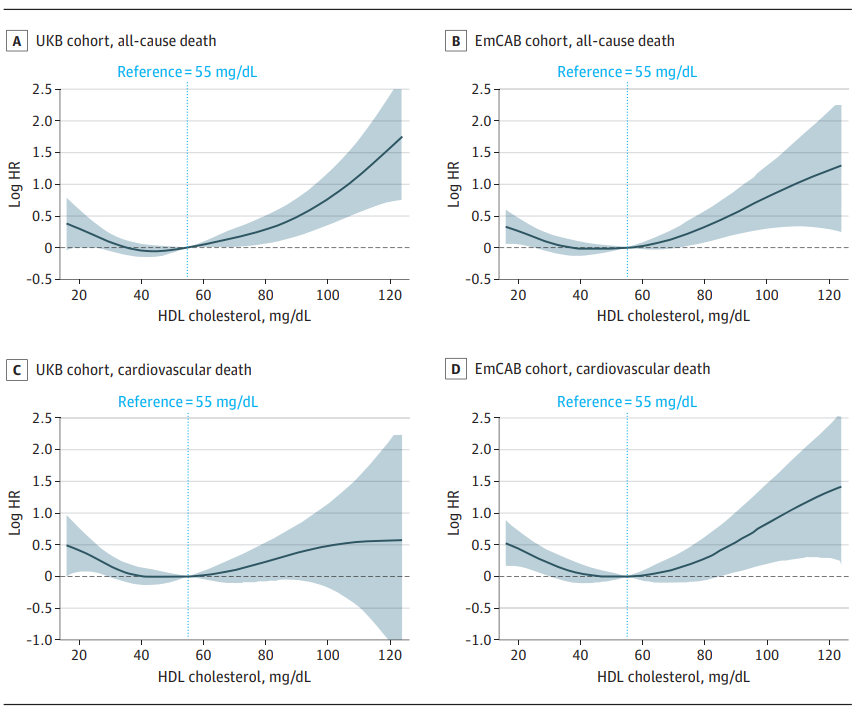
HDL-C水平与不良结局的非线性关系[4]
载脂蛋白A1(ApoA-1)
ApoA-I 是HDL颗粒的主要蛋白质成分(约占 65%~75%),而其他脂蛋白中ApoA-I 极少,所以血清 ApoA1 可以反映HDL颗粒水平,与HDL-C呈明显正相关,其临床意义也大体相似。正常人群ApoA1水平多在1.20~1.60 g/L范围内,女性略高于男性。少数情况如家族性高TG血症患者HDL-C往往偏低,但ApoA1不一定低,同时测定ApoA1与HDL-C有助于临床诊断。
ApoA-I是一种可溶性载脂蛋白,由APOA1基因编码,含有243个氨基酸。ApoA-I是作为前体蛋白由肝脏和肠道细胞合成并分泌,前体ApoA-I在血浆中被BMP1蛋白转化为ApoA-I,并且apoA-I在与肝、肠和泡沫细胞中的ABCA1相互作用后被脂质化以形成新生HDL。通过卵磷脂胆固醇酰基转移酶(LCAT)将新生HDL转化为成熟HDL,后者将游离胆固醇转化为胆固醇酯(CE),然后将其螯合到HDL颗粒的核心中。
成熟的高密度脂蛋白颗粒在与ABCG1、ABCG4和清道夫受体B1(SR-B1)相互作用后介导胆固醇从泡沫细胞流出。富含胆固醇的成熟HDL通过肝脏SR-B1将胆固醇酯输送到肝脏。未脂质化的apoA-I和新生HDL被肾脏过滤。
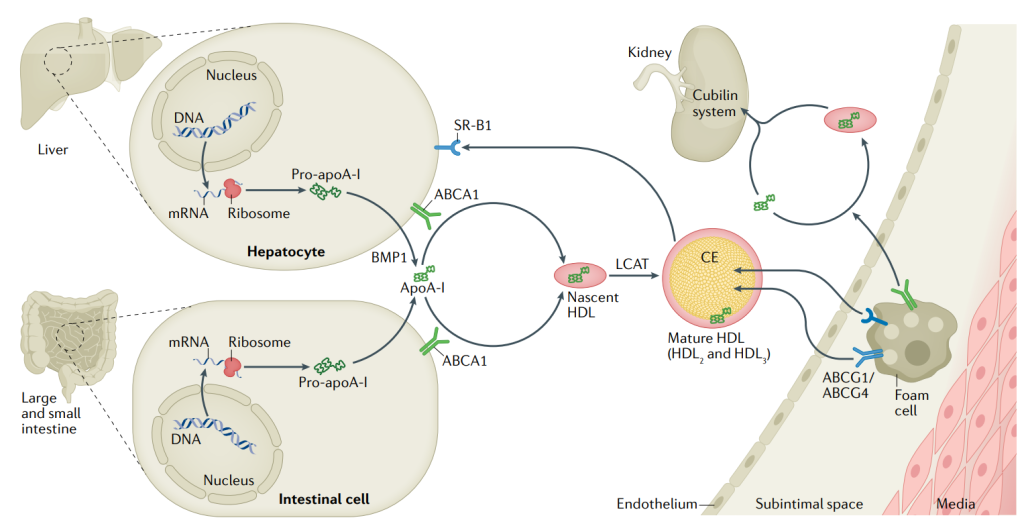
ApoA-I与胆固醇逆向转运作用[2]
如下图所示,ApoA-I就像一辆胆固醇回收车,空车状态的新生HDL由中心车站肝脏出发,通过循环系统从外周组织摄取脂质并转运回肝脏,完成脂质回收和再循环。在其行驶的路线中(下图蓝色车道),HDL可以和LDL完成直至交换,也可以从动脉中回收多余的胆固醇,防止原发性脂质积聚。
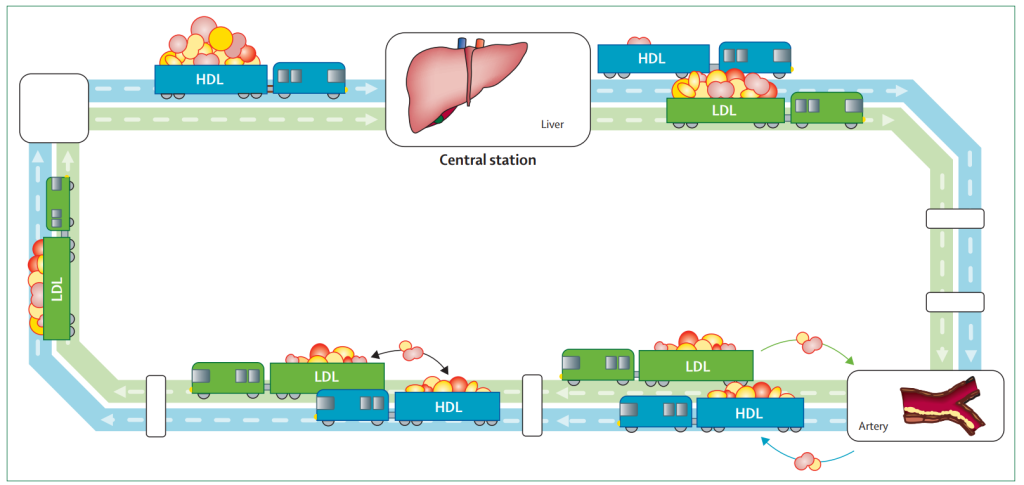
脂质转运系统[5]
APOA1基因变异
家族性低α脂蛋白血症(Familial hypoalphalipoproteinaemia)是一种由APOA1变异引起的常染色体显性遗传疾病。患有这种疾病的患者血浆HDL-C水平严重降低,过早发生ASCVD的风险增加。
有意思的是,ApoA-IMilano是一种天然存在的基因变体,在173位由精氨酸到半胱氨酸的取代。这种基因变异属于保护性变异,因为尽管携带者的血浆HDL-C水平较低,但ASCVD发病率较低。
ApoA-I作为治疗靶点
鉴于ApoA-I在清除胆固醇中的重要作用,它已被探索作为降低ASCVD风险的治疗靶点。
上文提到,ApoA-IMilano变异是一种APOA1基因的保护性变异,携带者ASCVD发病率较低,表明ApoA-IMilano可能具有抗动脉粥样硬化特性。ETC-216是一种重组HDL,由重组ApoA-IMilano和棕榈酰油酰磷脂酰胆碱构建。临床前研究表明,ETC-216可增加小鼠的RCT并减少动脉粥样硬化斑块。尽管后期的临床研究显示,短期应用ETC-216,冠状动脉粥样硬化斑块显著消退,但由于严重的不良反应,其研发被迫停止。除了ETC-216外,多种重组HDL均未达到预期的治疗效果。
CSL-112是一种新型的血浆衍生ApoA-I的制剂,它被重组形成HDL样颗粒。AEGIS-I试验评估了CSL-112在心肌梗死后患者中的安全性和耐受性,发现与基线相比,胆固醇外排能力立即增加了4倍[6]。但2024年,发表在NEJM的AEGIS-II临床试验显示,在患有急性心肌梗死、多支冠状动脉疾病和其他心血管危险因素的患者中,在90天内,与安慰剂相比,每周4次输注CSL112并不能降低心肌梗死、中风或心血管原因死亡的风险[7]。
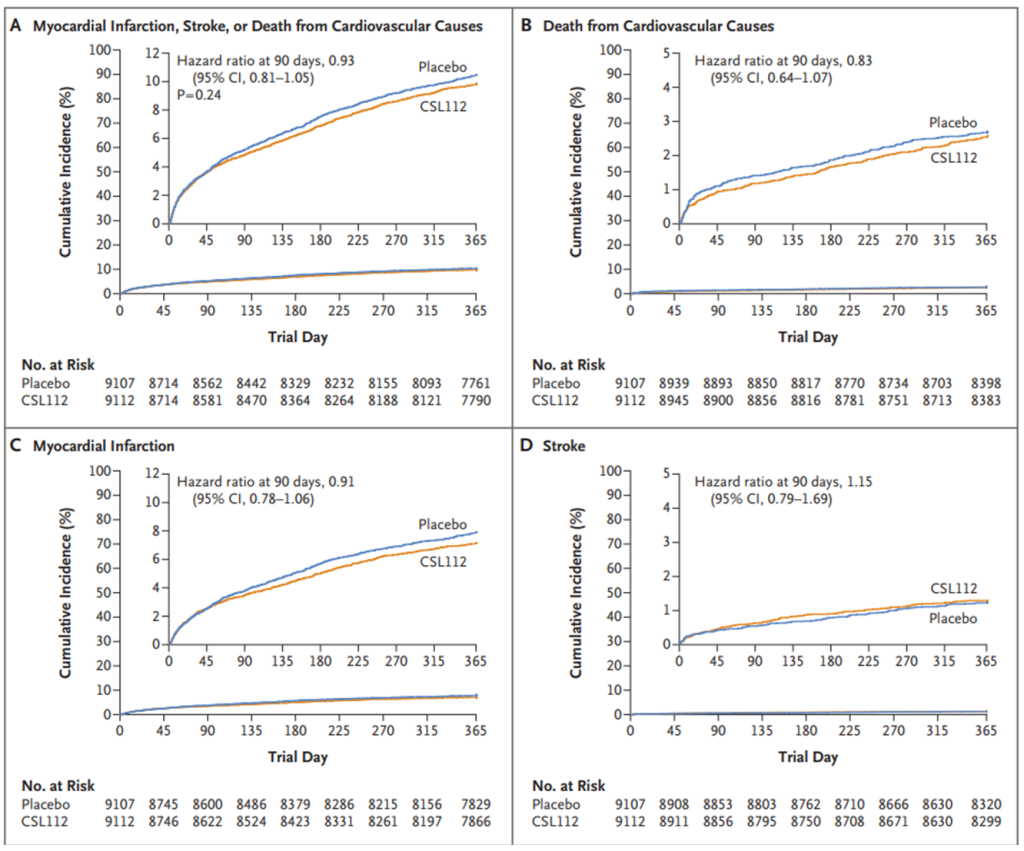
AEGIS-II临床试验结果[7]
事实上,HDL也是一类异质性脂蛋白,可分为不同亚组分。HDL实际上包含了数百种不同的脂质颗粒,而在实际临床中测量的HDL-C,是HDL中不同胆固醇和胆固醇酯的混合浓度,只反映了其中的胆固醇,其他种类并没有测量。同时,现有的大部分增加HDL-C水平的药物治疗(如烟酸、胆固醇酯转移蛋白抑制剂)临床试验并没有显示出心血管事件风险的降低。
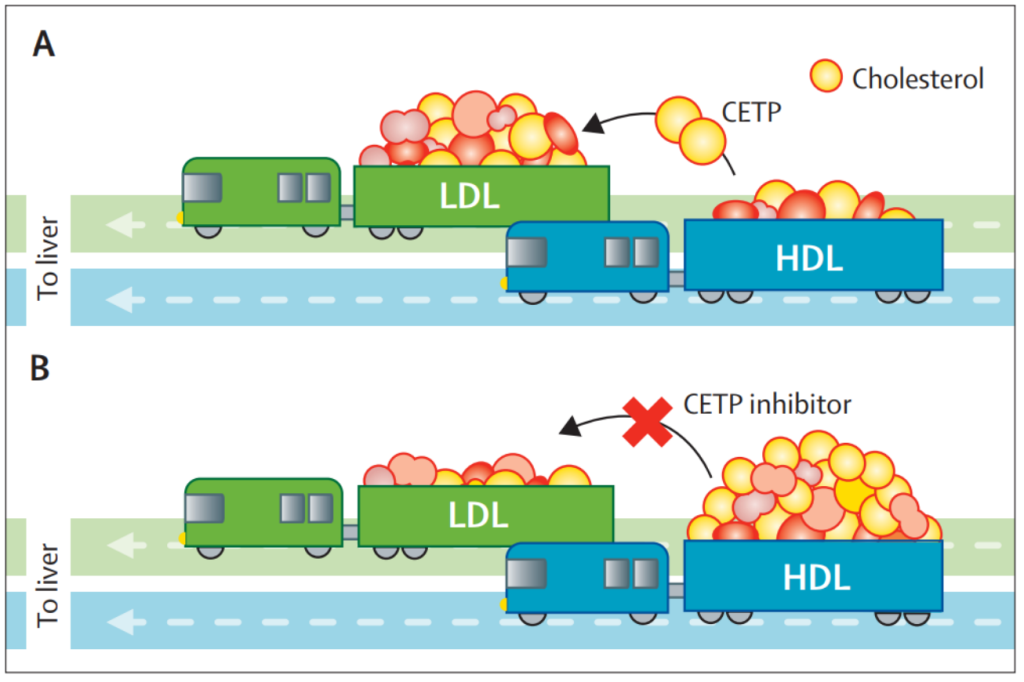
胆固醇酯转移蛋白(CETP)抑制剂工作原理[5]; CETP可以使胆固醇从HDL转移至VLDL和LDL中,而CETP抑制剂可阻断这一转移过程,理论上具有抗动脉粥样硬化和降低心血管风险的作用,但CETP抑制剂的药物研发多以提前终止而告终。
因此,有学者指出,人们需要重新审视HDL,并重点开发更好的检测方法来阐明HDL的功能,可以与基因组学、代谢组学、蛋白质组学和转录组学结合使用,以确定新的靶点和正确的人群,再测试改善胆固醇外排和HDL功能的治疗方法[8]。
参考资料
1. 中国血脂管理指南(2023 年). 中国循环杂志 2023 年 3 月 第 38 卷 第 3 期(总第 297 期)
2. Mehta A, Shapiro M D. Apolipoproteins in vascular biology and atherosclerotic disease[J]. Nature Reviews Cardiology, 2022, 19(3): 168- 179.
3. Navab M, Reddy S T, Van Lenten B J, et al. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms[J]. Nature Reviews Cardiology, 2011, 8(4): 222-232.
4. Liu C, Dhindsa D, Almuwaqqat Z, et al. Association between high-density lipoprotein cholesterol levels and adverse cardiovascular outcomes in high-risk populations[J]. JAMA cardiology, 2022, 7(7): 672-680.
5. Xiang A S, Kingwell B A. Rethinking good cholesterol: a clinicians’ guide to understanding HDL[J]. The Lancet Diabetes & Endocrinology, 2019, 7(7): 575-582.
6. Gibson, C. M. et al. Safety and tolerability of CSL112, a reconstituted, infusible, plasma- derived apolipoprotein A- I, after acute myocardial infarction: the AEGIS- I trial (ApoA- I Event Reducing in Ischemic Syndromes I). Circulation 134, 1918–1930 (2016).
7. Gibson C M, Duffy D, Korjian S, et al. Apolipoprotein A1 infusions and cardiovascular outcomes after acute myocardial infarction[J]. New England Journal of Medicine, 2024, 390(17): 1560-1571.
8. Ballantyne C M, Nambi V. HDL Therapeutics—Time for a Curtain Call or Time to Reconceptualize?[J]. New England Journal of Medicine, 2024, 390(17): 1622-1623.


