促衰老与抗衰老基因介绍(三):APOE在阿尔兹海默病、心血管病以及衰老中的作用
- boke
- 2025-08-22
- 11:04 上午
2025年4月,《CELL》发表的最新抗衰老研究文章《从衰老科学到精准衰老医学:认知与管控衰老》提出,衰老是一个过程,该过程由促衰老基因(Gerogenes)的驱动激活促进,并且也可被抗衰老基因(Gerosuppressors)来减缓,就像癌症是由癌驱动基因的激活引起的,并由抑癌基因来踩刹车阻止癌的进展
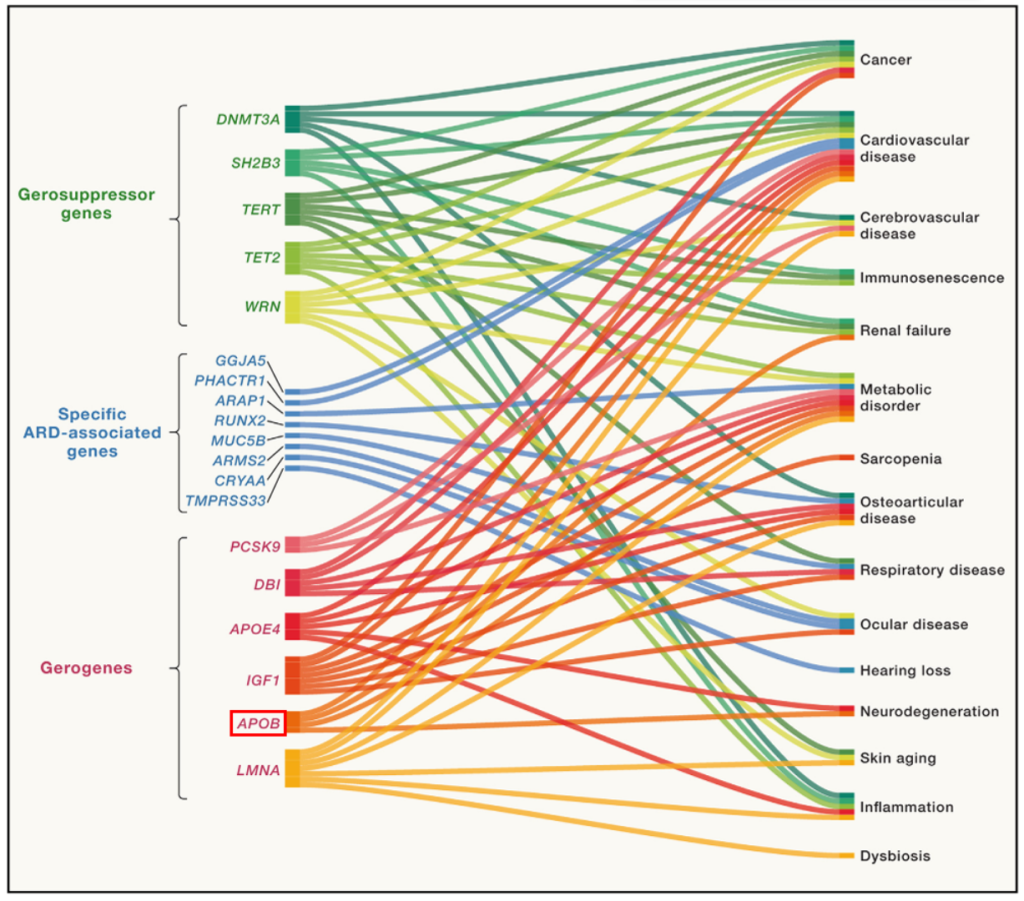
衰老相关基因与疾病表型关联[1]
今天,我们介绍第三个“促衰老基因”——APOE。APOE作为一种关键的脂质转运蛋白,其遗传多态性与阿尔茨海默病(AD)、心血管疾病(CVD)、衰老(Ageing)等的发生风险、发展进程及临床结局密切相关。
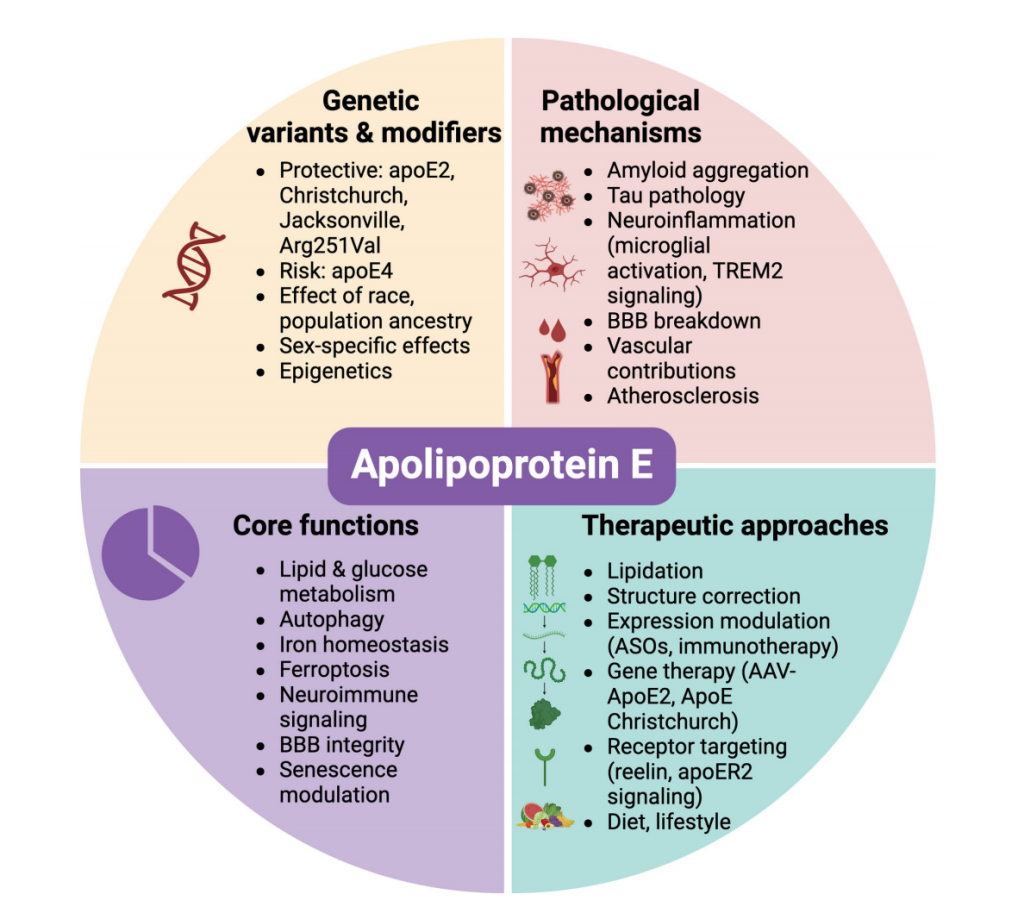
APOE 的生物学特征、与疾病和治疗的交叉点[2]
不同标志物与APOE各基因型的相关性[3]
一
APOE 的遗传结构特征和功能基础
APOE 基因定位于19号染色体19q13.2区域,与APOC1、APOC2等基因成簇排列,其遗传多态性由 rs429358(T/C)和 rs7412(C/T)两个单核苷酸多态性(SNP)决定,形成三种主要亚型:ε2(Cys112, Cys158)、ε3(Cys112, Arg158)和 ε4(Arg112, Arg158)。其中,ε3为最常见亚型(约占 80%);ε4是晚发性阿尔茨海默病(AD)最强的遗传风险因素,以剂量依赖方式增加发病风险并提前发病年龄;ε2则具有保护作用,显著降低 AD 风险,尤其ε2纯合子90岁前极少患病。
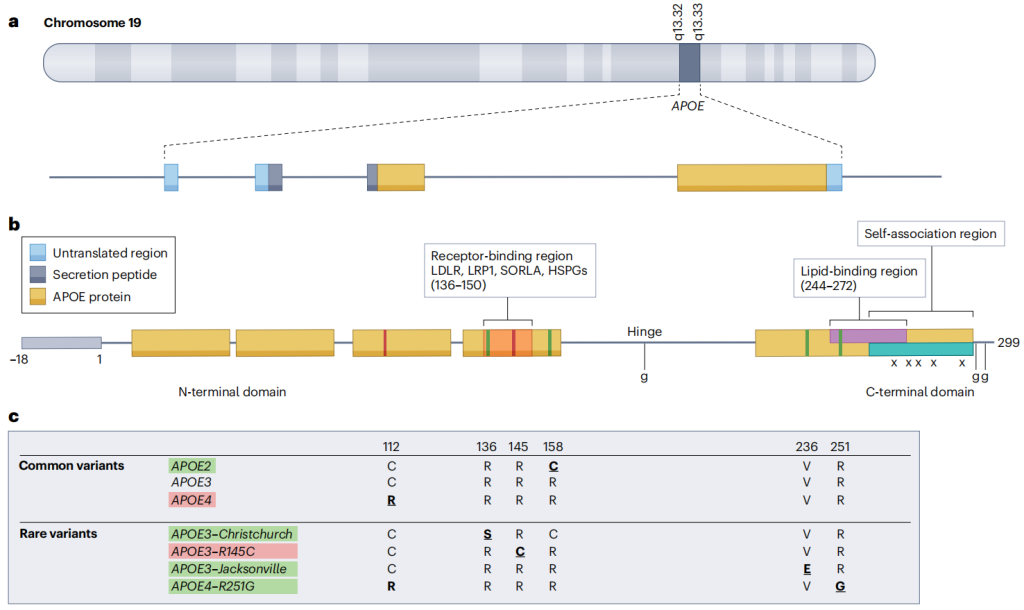
APOE 结构和功能区域的示意图[3]
此外,APOE多态性的效应存在种族和性别差异:东亚人群ε4相关阿尔兹海默症(AD)风险最高[3],非洲裔美国人ε2的保护作用减弱[19];60-70岁女性ε4携带者AD风险高于同龄男性,而年轻女性ε3/ε4携带者风险相对降低。
在不同系统中,APOE通过不同的调节方式发挥功能。在中枢神经系统中,APOE 主要由星形胶质细胞和小胶质细胞分泌,参与神经细胞膜维持、突触修复及Aβ肽的清除;在外周组织中,APOE 主要调节血浆脂质代谢,影响胆固醇和甘油三酯的运输与代谢平衡。
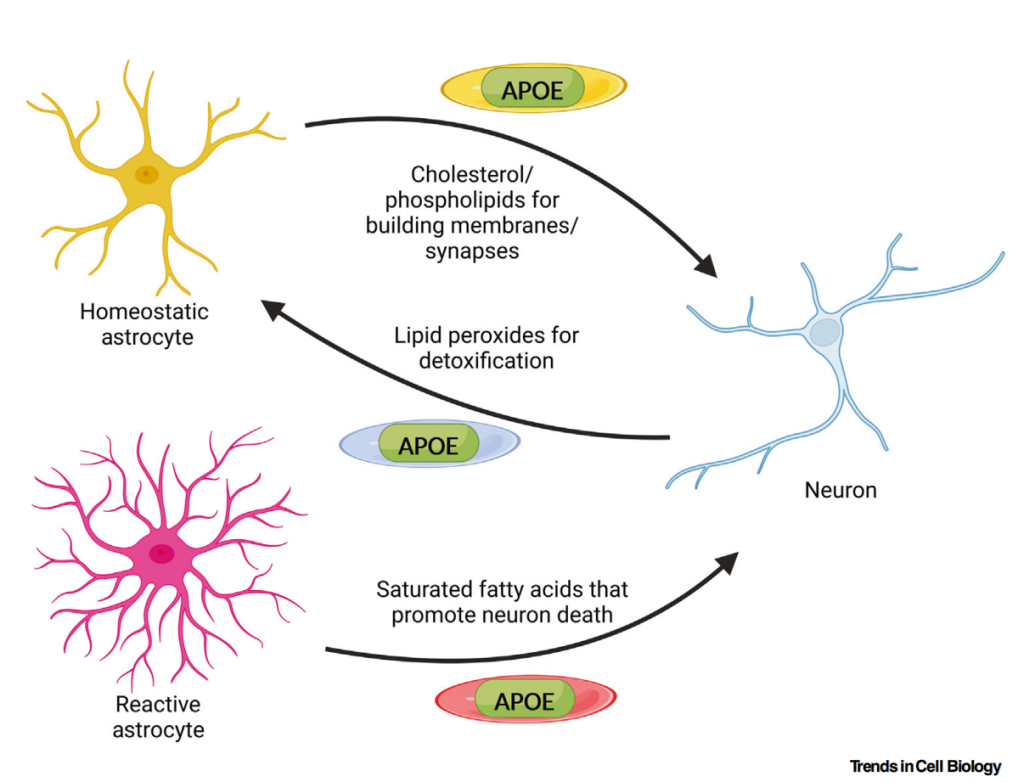
APOE介导的星形胶质细胞与神经元之间的细胞间脂质转运[4]
二
APOE 多态性与阿尔茨海默病
APOE ε4 携带者的认知衰退速率更快,尤其在记忆力、执行功能等流体认知领域表现显著[11,12,13]。
2024年发表的一篇文章研究探讨 APOE 是否与 SCD(主观认知衰退) 和轻度认知障碍(MCI)人群的认知变化速率相关。

——研究内容
来自拉什阿尔茨海默病中心研究共享数据库,共纳入 3494 名老年人(1990 名正常对照者、775 名 SCD 患者和 729 名 MCI 患者),平均随访时间为 9.09 年。采用线性混合效应模型分析 APOE 状态与老年人(包括 SCD 患者、正常对照者和 MCI 患者)认知变化的关系。
——研究结论
-
ε2等位基因对认知衰退具有保护作用;
-
ε4的加速作用:SCD-ε4个体的认知衰退速率显著高于所有其他组,包括 NC-ε4和 MCI-ε4组,且在整体认知、情景记忆、语义记忆等多个领域均表现出更快的衰退,提示ε4等位基因在 SCD 阶段对认知的有害影响最为显著。
-
临床意义:SCD 合并ε4等位基因是认知衰退的高风险标志,这一群体可作为临床前 AD 干预的关键靶点
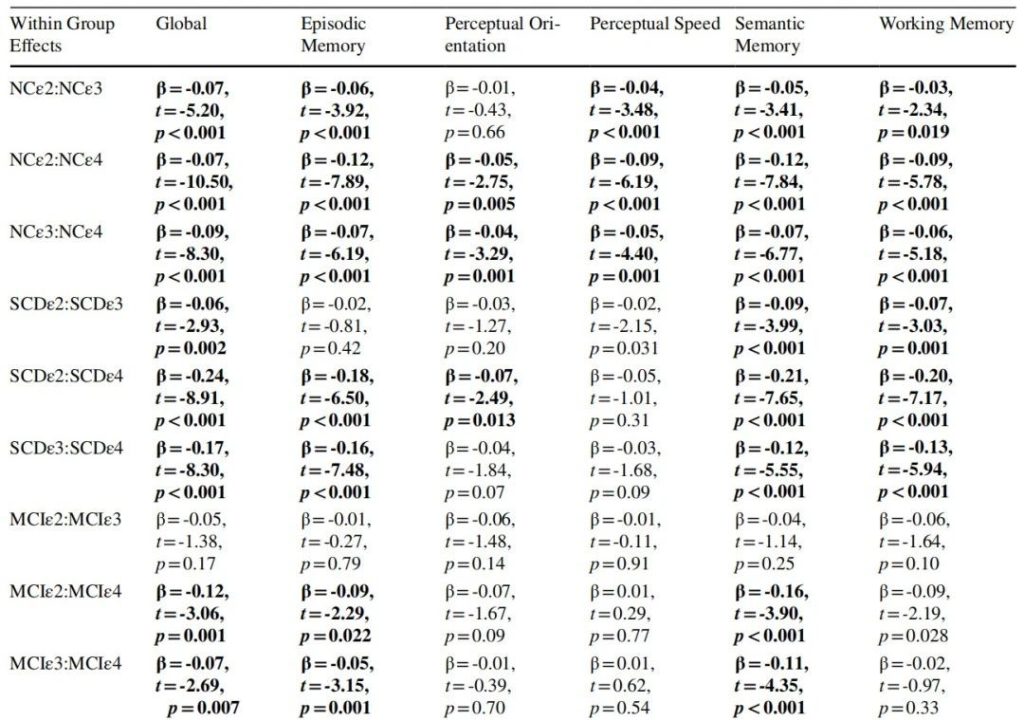
APOE 与 SCD线性混合效应模型的输出结果 [5]
2020年一项综合纵向队列研究,对APOE ε4 以及性别、年龄、血管风险因素和种族对认知衰退的影响进行了综合分析。

——研究内容
参与者为 19,225 名年龄在 54-103 岁的个体,来自 15 项纵向队列研究,平均随访 duration 为 1.2 至 10.7 年。使用两步个体参与者数据(IPD)荟萃分析汇总研究层面的分析结果,这些分析通过携带一个或两个 APOE ε4 等位基因预测记忆力和一般认知衰退,并分析年龄、性别、血管风险因素和种族对这些关联的调节作用。分别计算基线年龄较小(即 62 岁)和较大(即 80 岁)的男性和女性的汇总估计值。
——研究结果
-
APOE ε4 携带与女性更快的一般认知衰退和男性更快的记忆力衰退相关。在老年男性中观察到更强的剂量依赖性效应,携带两个与一个 APOE ε4 等位基因的男性一般认知和记忆力衰退更快。
-
血管风险因素与年轻女性 APOE ε4 对记忆力衰退的增强效应相关,但与老年男性 APOE ε4 对一般认知衰退的减弱效应相关。
-
APOE ε4 携带与记忆力衰退之间的关系在老年亚洲人中比在白人中更大。
-
APOE ε4 与男性和女性的认知衰退相关,尽管这些效应在男性中因年龄和携带两个 APOE ε4 等位基因而增强,在女性成年后期早期因血管风险因素数量较多而增强,并且在亚洲种族中更强。
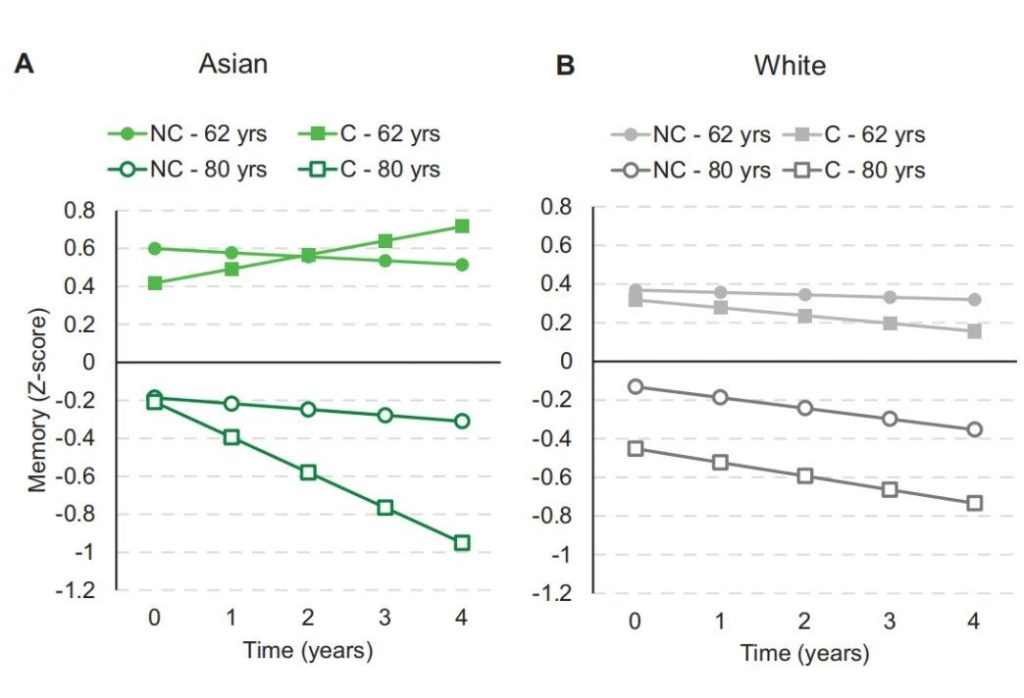
APOE ε4对认知能力下降的影响(亚裔与白人男性)[10]
2021年发表的一篇基于中国人群数据的横断面研究表明:中国 80 岁及以上成年人中 APOE ε4 与认知障碍风险增加 17% 相关[14]。
2020年的一篇文章,研究 APOE 和 APOE 区域外其他变体对年轻和年长参与者 AD 风险的影响[15]。结果表明: APOE 对疾病风险的影响在年轻参与者中更大,并随着参与者年龄的增长而降低;随着参与者年龄的增长,多基因风险评分的影响增加。
除此之外,ε4 携带者的脑成像显示更显著的结构性改变,包括海马体积缩小、白质高信号增加及脑年龄加速(BrainAGE);脑脊液中 Aβ 42 水平降低、tau 蛋白升高的比例更高;血浆 Aβ 40/42 比值也随 ε4 剂量增加而升高,可作为 AD 风险的早期预测指标[1]。
三
APOE在心血管疾病中的作用
冠心病(CHD)
一篇发表于2022年的研究,分析了APOE不同基因型与体重指数(BMI)、血脂(HDL-C、LDL-C、甘油三酯)、阿尔茨海默病(AD)和冠心病(CHD)之间的关联。

——研究内容
选取 17,244 名欧洲血统参与者的纵向数据,通过单变量分析、条件分析和中介效应*分析,剖析因素间的异质性关联四项纵向研究的综合分析。
*中介效应(Mediation Effect):用于描述自变量(X)通过一个或多个中间变量(即中介变量,M)间接影响因变量(Y)的过程)
——研究结果
-
CHD:ε2 通过 LDL-C 对 CHD 产生显著有益中介效应,ε4 通过 LDL-C 产生不利中介效应;两者均通过甘油三酯对 CHD 产生不利中介效应。
-
AD:仅 BMI 在 ε4 与 AD 的关联中起轻微中介作用,且该效应随年龄增加。
-
LDL-C 是 APOE 等位基因与 CHD 关联的关键中介,而 BMI 在 AD 中作用有限,血脂对 AD 无显著中介效应;高甘油三酯、高 LDL-C 和低 HDL-C 可能是 CHD 风险标志物,而低 BMI 可能与 AD 风险增加相关,为疾病预防提供潜在靶点。
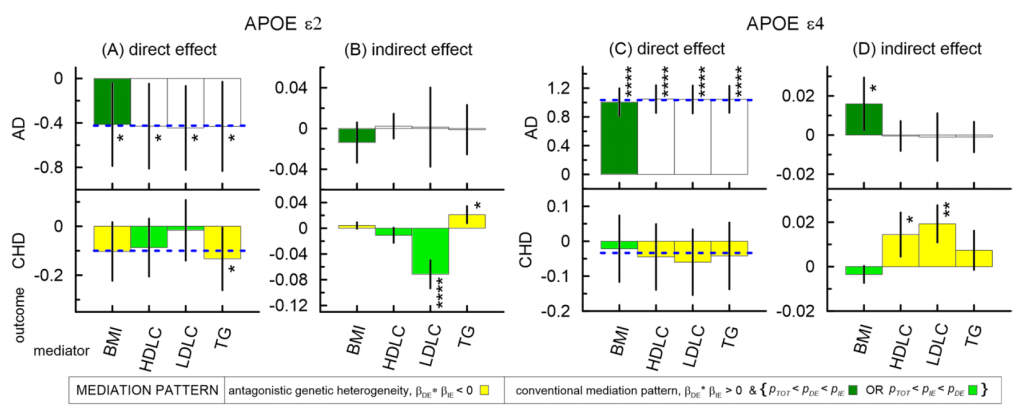
APOE ε2或 ε4等位基因与 AD 和 CHD 的关联关系的中介分析结果显示出直接和间接效应[7]
一篇发表于2024年的全基因组交互分析文章,采用 全基因组交互分析(GWIS) 方法分析遗传变异与年龄的交互作用。

——研究内容
选取英国生物样本库 270,276 名欧洲血统参与者的数据,识别对心脏代谢风险因素(APOB、LDL-C、TG、BMI、SBP)有年龄特异性影响的遗传变异,并在哥本哈根人群研究(CGPS)和爱沙尼亚生物银行(EstBB)中验证。
——研究结果
-
APOE rs429358与 APOB(交互作用 P=9.0e-14)和 TG(交互作用 P=5.4e-16)存在显著年龄交互作用。
-
另外 3 个变异(rs11591147(PCSK9)、rs34601365(APOB 附近)、rs17248720(LDLR 附近))与 APOB 相关。
-
效应随年龄变化:这些遗传变异的效应量随年龄增长减弱,例如 rs429358 纯合型对 TG 的影响在 40-49 岁组增加 1.11 倍,在 60-70 岁组仅增加 1.03 倍。
-
APOE rs429358 与年龄在 APOB 和 TG 上的交互作用在 CGPS 和 EstBB 中均得到验证,且在不同性别和 40-70 岁亚人群中稳定存在。
这一发现为理解年龄相关心脏代谢风险的遗传机制提供了新见解,对不同年龄人群的心血管疾病预防和精准干预具有重要意义。
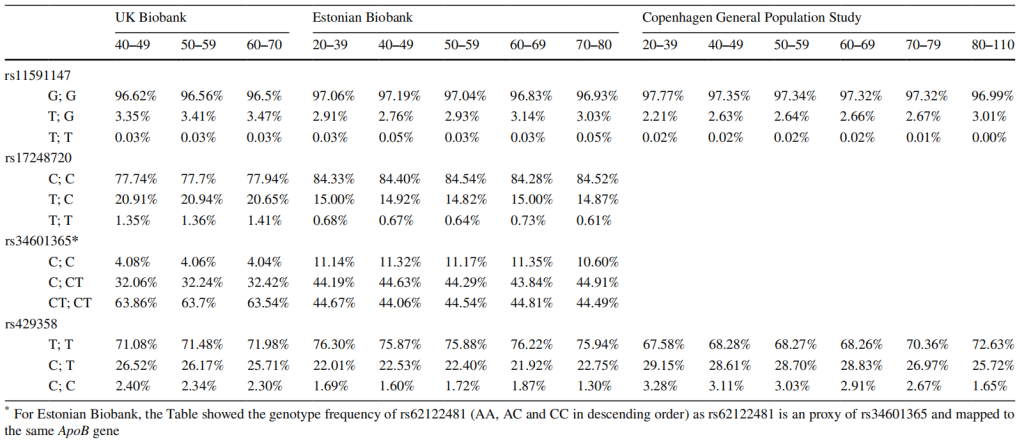
已鉴定的先导变异在不同年龄组中的基因型分布[6]
家族性高胆固醇血症(FH)
普遍认为家族性高胆固醇血症的经典致病基因为 LDLR、APOB 和 PCSK9,在2024年APOE 基因的 p.(Leu167del) 突变作为新候选基因被纳入研究。

——研究结果
-
突变与疾病关联:p.(Leu167del) 突变通过家族分离研究、脂蛋白分析及细胞功能实验证实与家族性高胆固醇血症相关,携带者表型与经典基因突变所致疾病无法区分,但对降脂治疗反应更好。 -
频率特征:在欧洲人群临床疑似家族性高胆固醇血症个体中,该突变检出率为 0.1%-1%;在排除经典基因突变的个体中可达 3%-7%,故建议将 APOE 纳入遗传诊断。 -
致病机制:突变导致 VLDL 中APOE 含量降低,通过增强脂蛋白被肝细胞摄取,下调 LDL 受体表达,减少 LDL 内化,最终使血浆 LDL-C 升高。 -
APOE p.(Leu167del) 突变是家族性高胆固醇血症的新致病因素,其机制为下调 LDL 受体,且携带者降脂治疗反应更优。因此,APOE 应作为家族性高胆固醇血症遗传诊断的候选基因之一。
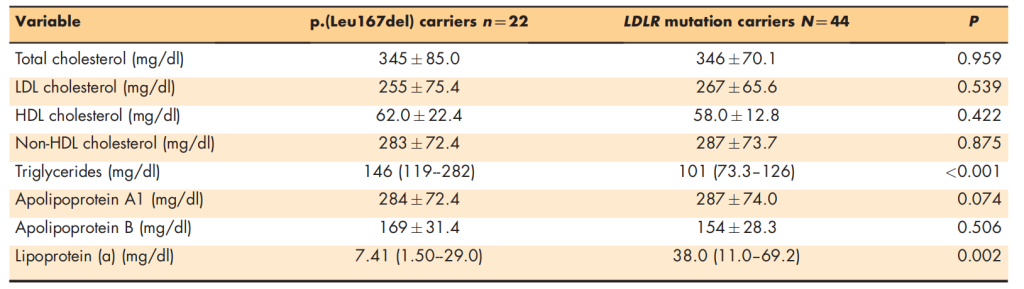
APOE p.(Leu167del)突变携带者与LDLR功能突变的匹配家族性高胆固醇血症个体的生化特征[8]
四
APOE 与衰老及长寿
APOE ε2 是人类长寿的重要遗传标志物:ε2 携带者更易存活至 90 岁以上,其父母的极端长寿(前 10%)概率增加 14%。这种长寿优势可能源于 ε2 对 AD、心血管疾病等衰老相关疾病的综合保护作用。相反,ε4 等位基因的频率随年龄增长显著降低,85 岁以上人群的 ε4 纯合子频率仅为 60 岁以下人群的 1/3,提示 ε4 可能通过增加早年疾病死亡率降低长寿概率。
但 ε2 的长寿效应并非绝对:ε2 携带者在老年期可能面临其他健康风险,如骨折风险升高(OR=1.28),提示 APOE 的作用具有多效性,需综合评估其对健康跨度的整体影响。
2021年基于英国生物样本库的一项遗传关联研究,通过比较两种生物年龄测量指标的遗传关联揭示不同的衰老表型。

——研究内容
对英国生物样本库中欧洲血统参与者的两种年龄调整生物年龄测量指标(表型年龄加速和生物年龄加速)进行了全基因组关联扫描,这些指标通过临床生物化学标志物估算。
——研究结果
-
最强信号出现在 APOE 基因中; -
表型年龄加速 —rs429358(APOE ε4 决定因素)(p=1.50×10-72); -
生物年龄加速 —rs7412(APOE ε2 决定因素)(p=3.16×10-60); -
APOE ε2 和 ε4 的反向关联。
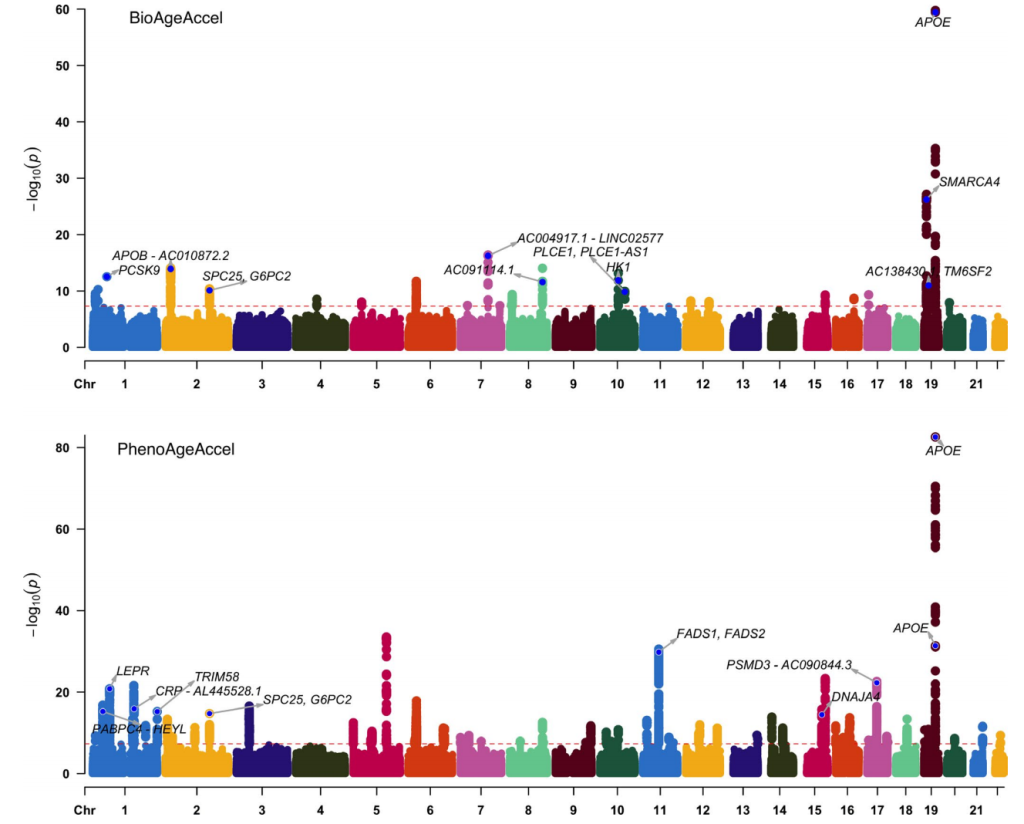
PhenoAgeAccel(下)和BioAgeAccel(上)曼哈顿图[9]
五
其他疾病
APOE 多态性还与代谢健康相关:ε4 与 2 型糖尿病风险轻度升高相关,可能通过影响胰岛素敏感性和 β 细胞功能介导;ε2 则与肥胖风险降低相关,但可能增加非酒精性脂肪肝的易感性[16]。
2019年一项基于中国老年 APOE ε3/ε3 基因型人群中血糖升高与认知衰老相关研究,招募了 282 名无痴呆的老年人,并将参与者分为 APOE ε2 组(ε2/ε2、ε2/ε3)、ε3 组(ε3/ε3)和 ε4 组(ε3/ε4、ε4/ε4)。结果发现,在 APOE ε3 组中,血糖升高与即时记忆、执行功能和知觉推理认知衰退相关;在 APOE ε4 组中,血糖升高也与抽象推理能力下降相关[17]。
六
临床转化与治疗潜力
01
生物标志物应用
APOE 基因型已成为各类疾病相关风险预测的重要生物标志物:在 AD 领域,结合 ε4 状态和血浆 Aβ 40/42 比值、脑成像指标可提高早期诊断准确率;在心血管疾病中,ε4 可优化风险评分模型,识别高风险个体;在长寿研究中,ε2 状态有助于评估健康长寿潜力。
02
治疗策略展望
当前研究聚焦于多种 APOE 靶向疗法:阻断 APOE 与 Aβ 或受体的相互作用(如肽模拟物、Christchurch突变模拟抗体)、提高 ε2 水平(AAV 基因治疗已进入临床 I 期)、降低 ε4 水平(反义寡核苷酸、抗 APOE 抗体)、增强 APOE 脂化(ABCA1 激动剂)及纠正 ε4 构象(小分子结构矫正剂)。这些策略在动物模型中显示出减少病理、改善认知的潜力,但需解决血脑屏障穿透、给药时机等问题。

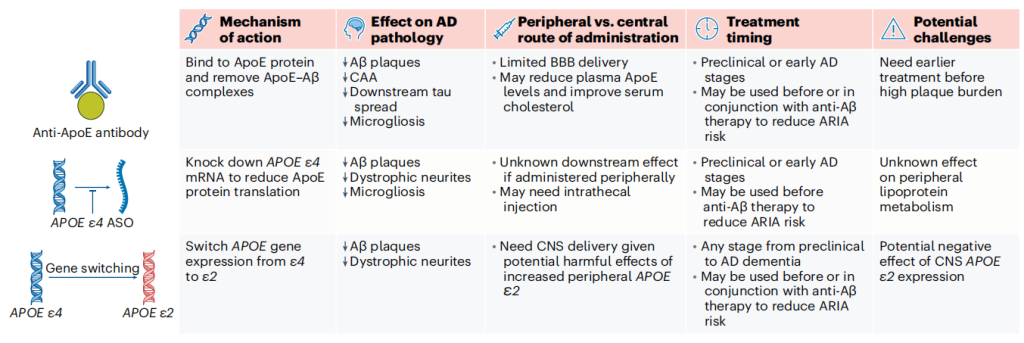
APOE靶向治疗[19]
(1)降低 ε4 毒性:针对 ε4 的小分子药物正处于研发阶段,旨在降低其神经毒性:
抗体疗法:抗 APOE 抗体优先结合非脂化 ε4,减少 Aβ 斑块和 CAA,降低淀粉样蛋白相关成像异常(ARIA)风险。
反义寡核苷酸(ASOs):抑制 ε4 表达,在 AD 小鼠模型中减少 Aβ 和 tau 病理,需在斑块出现前干预以获最佳效果。
结构矫正:几种小分子结构矫正剂(如 GIND25 和 PH002)是酞嗪酮衍生物,直接结合 APOE4,改善 ε4 构象,减少 tau 和 Aβ 病理,恢复神经元树突棘发育。特别是,PH002 挽救了原代神经元中APOE4 诱导的树突棘发育障碍。
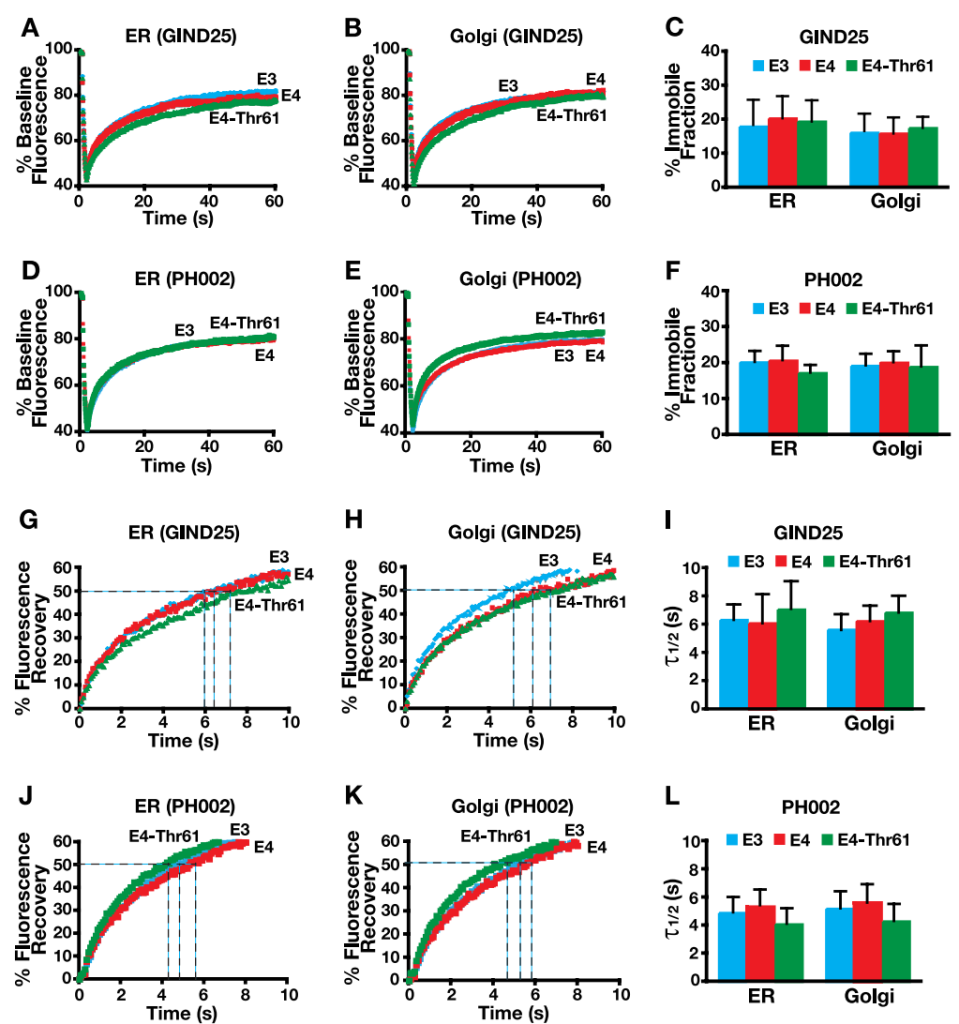
GIND25和PH002拯救了神经-2细胞中EGFP-APOE4的细胞内运输受损[20]
(2)增强 ε2 保护作用
基因疗法:腺相关病毒(AAV)介导的脑内 APOE ε2变体过表达减少 AD 小鼠模型中的淀粉样蛋白沉积、突触丢失和小胶质细胞过度激活。更重要的是,在存在内源性 APOE ε4风险变体表达的情况下,脑内 APOE ε2表达的有益效果得以实现,表明 APOE ε2可以抵消 APOE ε4在体内的一些有害影响。
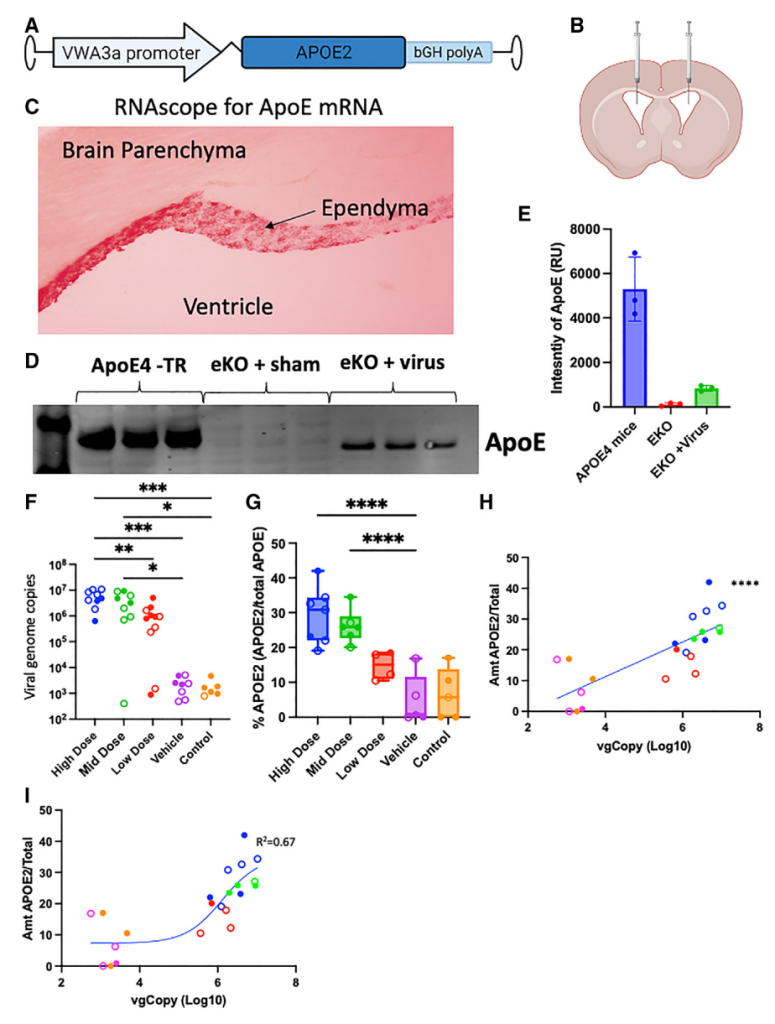
由 AAV 驱动的 APOE ε2 的 Ependymal cell表达[21]
基于这些结果,一项 I 期临床试验探索了通过脑池内注射 AAV 介导的 APOE ε2 在 APOE ε4纯合子中的表达,尽管纳入的参与者数量较少,但该 I 期试验报告的安全性结果令人鼓舞(NCT03634007)。
(3)Christchurch变体模拟
APOE ε3 Christchurch(R136S)变体通过降低与硫酸乙酰肝素蛋白聚糖结合,减少 tau 传播,在家族性 AD 中显示强保护作用。
(4)脂化调节
LXR/RXR 激动剂(如贝沙罗汀)增强 ABCA1/ABCG1 介导的 APOE 脂化,减少 Aβ 沉积,但需优化脑特异性以避免外周副作用。
03
非药物干预
基于 APOE 基因型的精准预防策略前景广阔:对 ε4 携带者强化血脂管理(如他汀类药物使用)、认知训练和生活方式干预,可能延缓疾病发生;补充 B 族维生素(如 B12、B6)可通过降低同型半胱氨酸水平,减轻 ε4 与认知衰退的关联,为高风险人群提供可行的干预手段。
七
结论与展望
APOE 基因多态性通过调控脂质代谢、神经保护、免疫反应等通路,在衰老相关疾病的发生发展中发挥核心作用:ε4 是 AD 和心血管疾病的主要风险因素,ε2 则具有显著保护作用,ε3 为中性基准。其效应具有年龄依赖性、剂量依赖性和人群异质性,并受生活方式、社会环境等因素的显著调节。
目前,需深入探索APOE人群特异性机制、亚型与受体互作的结构基础,以及多组学整合应用。基于天然保护性变体的基因疗法和精准靶向策略,有望为 AD 高风险人群提供新型防治手段。
参考文献:
Kroemer, Guido et al. From geroscience to precision geromedicine: Understanding and managing aging. Cell, Volume 188, Issue 8, 2043 – 2062
Abdel Ali Belaidi, et al. Apolipoprotein E in Alzheimer’s disease: molecular insights and therapeutic opportunities. Belaidi et al. Molecular Neurodegeneration. (2025) 20:47
Rosemary J, et al. Multifaceted roles of APOE in Alzheimer disease. Nature Reviews Neurology, 20, pages457–474 (2024)
Ian A. Windham1 and Sarah Cohen. The cell biology of APOE in the brain. Trends in Cell Biology, April 2024, Vol. 34, No. 4
Cassandra Morrison, et al. The influence of APOE status on rate of cognitive decline. GeroScience (2024) 46:3263–3274
Linjun Ao, et al. Large‑scale genome‑wide interaction analyses on multiple cardiometabolic risk factors to identify age‑specific genetic risk factors. GeroScience, 25 September 2024
Yury Loika, et al. Mediation of the APOE associations with Alzheimer’s and coronary heart diseases through body mass index and lipids. GeroScience (2022) 44:1141–1156
Fernando Civeiraa, et al. APOE and familial hypercholesterolemia. Curr Opin Lipidol 2024, 35:195–199
Chia-LingKuo, et al. Genetic associations for two biological age measures point to distinct aging phenotypes. Aging Cell. 2021;20:e13376
Steve R Makkar, et al. APOE ε4 and the influence of sex, age, vascular risk factors, and ethnicity on cognitive decline. J Gerontol A Biol Sci Med Sci. 2020 Sep 25;75(10):1863-1873.
Ian Deary, et al. Effect sizes of APOE e4 on the same general cognitive ability test taken by the same people from age 11 to age 90: The Lothian Birth Cohorts 1921 and 1936. Res Sq. 2025 May 7:rs.3.rs-6462650
Janie Corley, et al. Predictors of longitudinal cognitive ageing from age 70 to 82 including APOE e4 status, early-life and lifestyle factors: the Lothian Birth Cohort 1936. Mol Psychiatry. 2023 Mar;28(3):1256-12712
Ruth A Sibbett, et al. Does Incipient Dementia Explain Normal Cognitive Decline Determinants? Lothian Birth Cohort 1921. Psychol Aging. 2018 Jun;33(4):674-684
Xurui Jin, et al. Association of APOE ε4 genotype and lifestyle with cognitive function among Chinese adults aged 80 years and older: A cross-sectional study. PLoS Med. 2021 Jun 1;18(6):e1003597.
Eftychia Bellou, et al. Age-dependent effect of APOE and polygenic component on Alzheimer’s disease. Neurobiol Aging. 2020 Sep:93:69-77
Dylan Ellis, et al. APOE genotype and biological age impact inter-omic associations related to bioenergetics. Aging (Albany NY). 2025 May 3;17(5):1105-1138.
Qi Qiu, et al. Cognitive decline is related to high blood glucose levels in older Chinese adults with the ApoE ε3/ε3 genotype. Transl Neurodegener. 2019 Apr 3:8:1
AC-1202 Corrects APOE4 Conformation and Reduces Amyloid Burden in Alzheimer’s Disease: Results from Phase II Trial. AHA 2025
Sneha Narasimhan, et al. Apolipoprotein E in Alzheimer’s disease trajectories and the next-generation clinical care pathway. Nature Neuroscience | Volume 27 | July 2024 | 1236–1252
Jens Brodbeck, et al. Structure-dependent Impairment of Intracellular Apolipoprotein E4 Trafficking and Its Detrimental Effects Are RescuedbySmall-molecule Structure Correctors. THE JOURNALOFBIOLOGICALCHEMISTRY VOL.286, NO. 19, pp. 17217–17226, May 13, 2011
Rosemary J. Jackson, et al. APOE2 gene therapy reduces amyloid deposition and improves markers of neuroinflammation and neurodegeneration in a mouse model of Alzheimer disease. Molecular Therapy Vol. 32 No 5 May 2024
推荐阅读
APOE介导的星形胶质细胞与神经元之间的细胞间脂质转运[4]
二
APOE 多态性与阿尔茨海默病
APOE ε4 携带者的认知衰退速率更快,尤其在记忆力、执行功能等流体认知领域表现显著[11,12,13]。
2024年发表的一篇文章研究探讨 APOE 是否与 SCD(主观认知衰退) 和轻度认知障碍(MCI)人群的认知变化速率相关。


