JAMA Cardiology | 十年随访,高Lp(a)导致冠状动脉斑块进展的影像学证据
- boke
- 2024-08-23
- 10:58 上午
脂蛋白(a)[Lp(a)]是心脑血管疾病的致病风险因素;然而,Lp(a)对冠状动脉粥样硬化斑块表型、高危斑块形成和冠状动脉周围脂肪组织炎症的长期影响仍然未知。
与低密度脂蛋白(LDL)不同,临床前研究表明,脂蛋白(a)[Lp(a)]的致动脉粥样硬化性主要源于其所携带的氧化磷脂,这些物质能在斑块层面启动促炎和促钙化途径。
近日,发表《JAMA Cardiology》期刊上的一项重要研究-“Lipoprotein(a) and Long-Term Plaque Progression, Low-Density Plaque, and Pericoronary Inflammation”,深入研究了Lp (a)水平与长期冠状动脉斑块的进展、高危斑块和冠状动脉周脂肪组织炎症的相关性[1]。

这项前瞻性队列研究纳入了299名疑似冠状动脉疾病(CAD)的患者,这些患者接受了间隔10年的重复冠状动脉计算机断层扫描血管造影(CCTA)成像。数据收集时间从2008年10月持续至2022年10月,分析时间则从2023年3月开始至2024年3月结束。最终完成研究的267名患者平均年龄为57.1岁(标准差为7.3岁),其中男性有153人(占57%)。

之前多项研究表明,超过90%的成年人血浆Lp(a)水平在一生中是稳定的,因此在整个研究过程中,Lp(a)水平被认为是恒定的。在当前研究中,Lp(a)水平≥ 125 nmol/L(~500 mg/L)被视为高Lp(a)水平。
与低水平Lp(a)患者相比,高Lp(a)患者在基线时就具有更高的PAV(动脉粥样硬化斑块体积百分比)、非钙化斑块体积百分比和钙化斑块体积百分比。
相比低Lp(a)水平的患者,高Lp(a)患者在基线和随访期间斑块进展也更为显著。具体来说,高Lp(a)患者PAV的绝对变化为3.6,而低Lp(a)为1.6。非钙化斑块体积百分比为1.1 vs 0.5;钙化斑块体积百分比为2.2 vs 0.7。
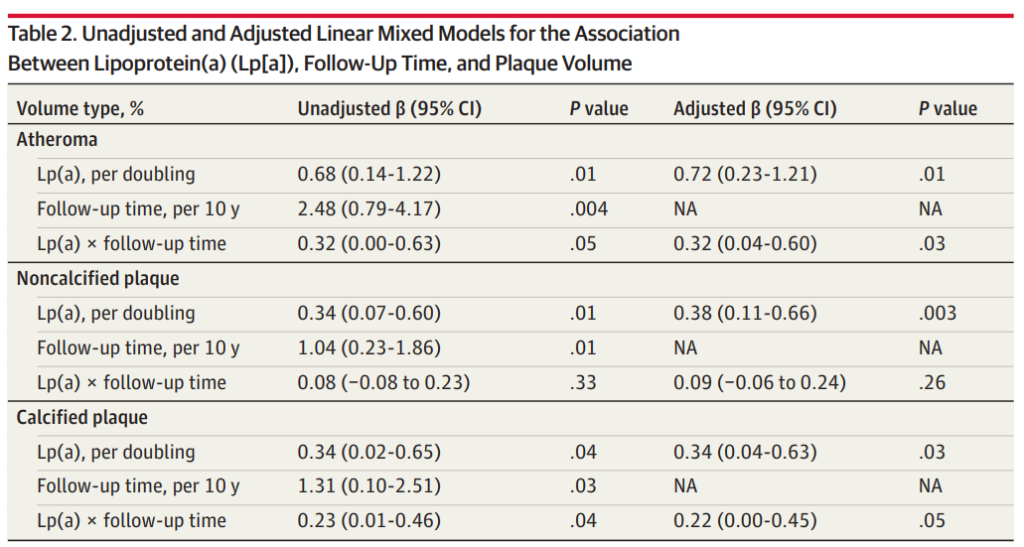
在矫正了其他风险因素后,Lp(a)每增加一倍,每10年的随访期间,PAV会额外增加0.32%。
此外,高Lp(a)患者在基线和随访时更容易出现高危斑块(低密度斑块)和炎症增加(PCATa)。
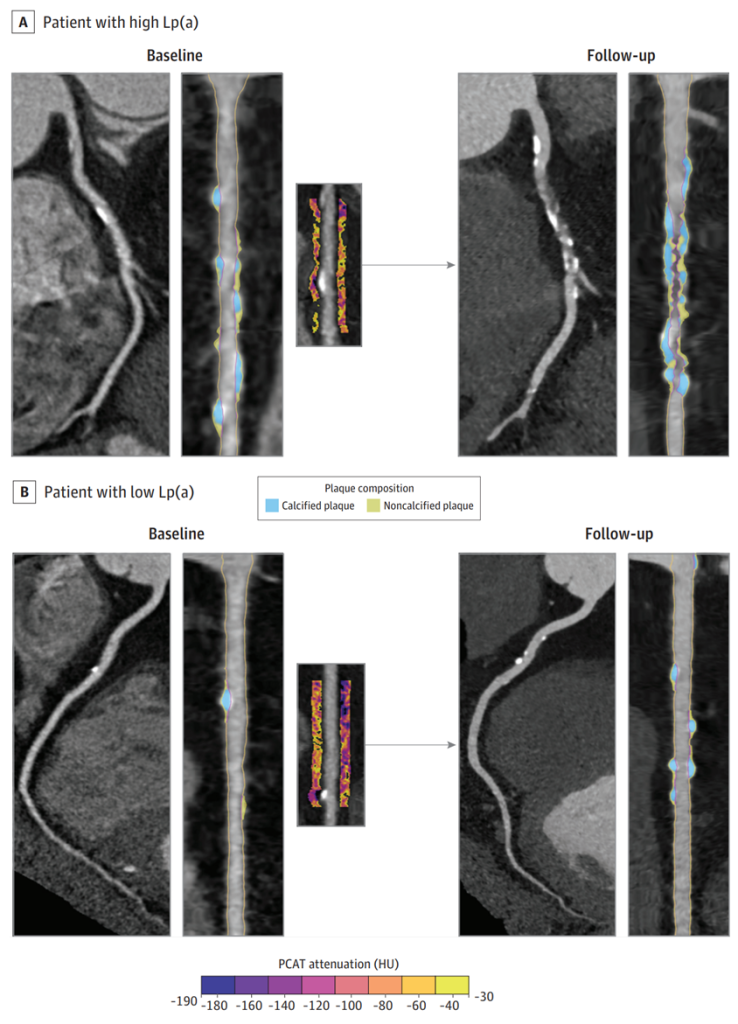
如下图所示,两个病例示例:高Lp(a)(A)和低Lp(a)(B)患者,基线包括右冠状动脉CCTA曲面重建图、直线重建图以及其周围冠状动脉脂肪组织衰减(PCATa,提示炎症)。
在基线时,患者A与B的PAV分别为19.4%/11.6%,非钙化斑块体积百分比为6.1%/5.8%,钙化斑块体积百分比为13.3%/5.8%,而右冠状动脉的PCATa为-79.1 HU(提示炎症)/ -94.8 HU(提示无炎症)。
在10年的随访期间,患者A与B的PAV分别为30.0%/11.2%,非钙化斑块体积百分比为12.2%/4.4%,钙化斑块体积百分比为15.8%/6.7%。患者A与B的PAV、非钙化斑块体积百分比和钙化斑块体积百分比变化分别为+55%/-3%、+100%/-24%和+19%/+19%,提示患者A斑块进展,患者B斑块稳定。
研究首次表明,在为期10年的独特长期随访中,患者的冠状动脉斑块负担总体上呈现更高程度的进展。由于进行了长期随访,数据提供了关于Lp(a)对斑块进展过程影响的重要信息。同时,借助先进的动脉粥样硬化成像定量计算机断层扫描技术,实现了对斑块组成以及斑块和冠状周炎症的可靠且精确的量化。这些数据表明,冠状动脉内皮暴露于Lp(a)不仅加速了冠状动脉斑块的进展速度,还导致了冠状周炎症的加剧和低密度斑块的增多。
冠状动脉周围脂肪组织和斑块的持续炎症最终可能导致斑块进展加速,从而导致更高的斑块负担,但最重要的是,可能导致高风险、易破裂斑块的发展,这解释了高Lp(a)水平患者心肌梗死风险增加的原因。Lp(a)水平对斑块进展、低密度斑块和冠状动脉周围炎症的影响对临床实践具有重要意义。科学家们热切期待未来研究能够探讨降低Lp(a)水平的疗法对冠状动脉斑块负担及冠状周炎症的影响。
参考资料1. Nurmohamed N S, Gaillard E L, Malkasian S, et al. Lipoprotein (a) and Long-Term Plaque Progression, Low-Density Plaque, and Pericoronary Inflammation[J]. JAMA cardiology, 2024.


