心肌病和心律失常基因变异对房颤消融治疗的影响
- boke
- 2025-08-15
- 11:05 上午

研究背景
推进房颤(AF)的个性化治疗,需要找出能针对性治疗以及跟临床结果有关的因素。在65岁以下出现房颤(AF)患者中,大约10%到20%的存在心肌病(CM)和心律失常基因的致病性罕见变异。
最明显的例子是TTN、MYBPC3、LMNA和PKP2基因,它们分别与扩张型心肌病(DCM)、肥厚型心肌病(HCM)、心律失常性左心室心肌病(ALVC)和心律失常性右心室心肌病(ARVC)有关。
导管消融术是治疗房颤(AF)的常用方法,尤其适用于年轻患者,临床风险因素较少。而年轻患者也更容易携带心肌病(CM)和心律失常基因的致病性变异,这些变异可能导致心房肌病变或离子通道功能障碍异常,从而促进房颤。同时,房颤消融术治疗后心房肌病变患者复发率较高。
近年来,基因检测正在被采纳,以评估早期或家族性房颤的病因。某些患者可能携带了心肌病(CM)和心律失常基因的致病变异,如何利用这些基因变异对指导AF消融治疗尚不清楚。
研究目标:
为解决这一知识缺口,我们尝试按照基因亚组分类检验两个假设:
1)携带任何明确的心肌病或心律失常基因的致病性变异的参与者,与对照组相比,其复发风险更高;
2)携带与特定综合征(ALVC、ARVC、DCM、HCM或离子通道病)相关基因的致病性变异的参与者,与对照组相比,其复发风险更高。
此外,还进一步分析了最常见基因(如TTN、MYBPC3、MYH7、LMNA和KCNH2)的复发率。
研究方法
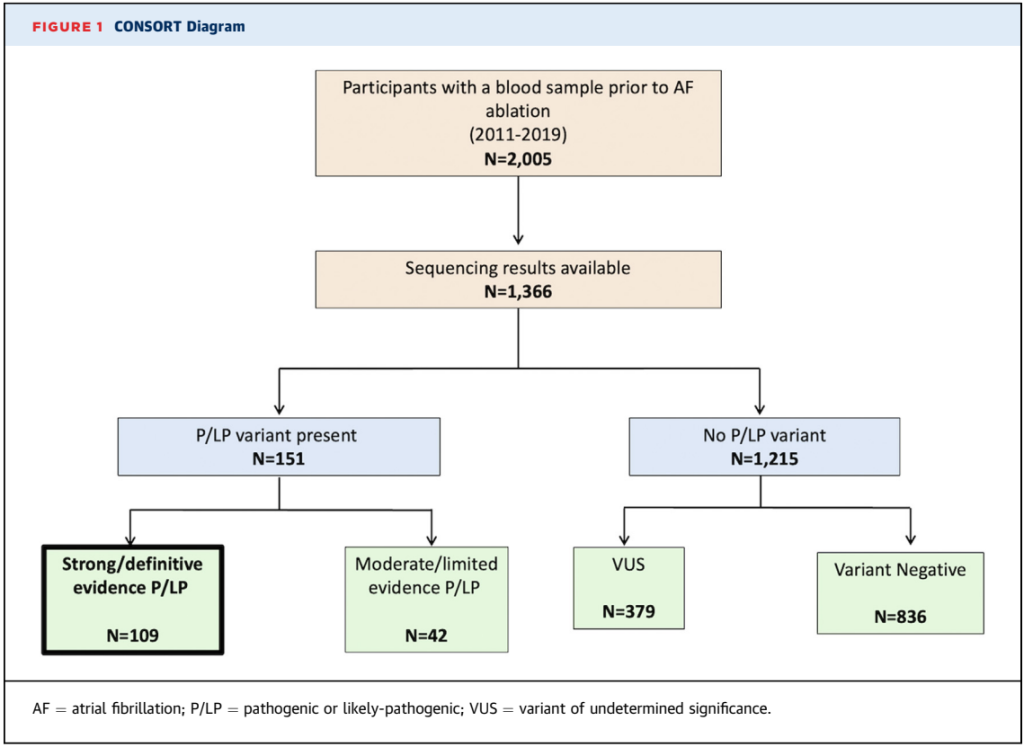
我们对接受房颤导管消融和WES Panel测序的患者进行了一项前瞻性、观察性队列研究。主要结局指标为90天空白期后出现的任何房性心律失常,持续时间≥30秒。
研究结果
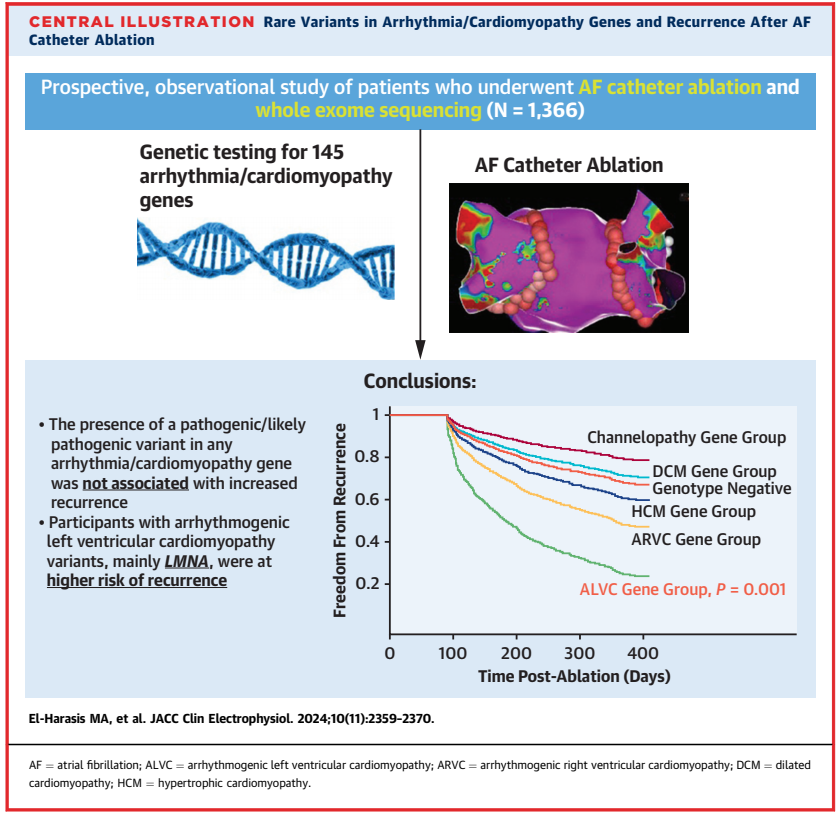
在1,366名参与者中,有109名(8.0%)在心肌病或心律失常基因中存在致病或疑似致病性(P/LP)变异。在多变量分析中,任何基因中P/LP变异的存在与复发无显著关联(HR 1.15)。在ALVC基因亚组中,主要为LMNA的P/LP变异与复发增加相关(n=10;HR 3.75)。具有TTN P/LP变异(n=46)的参与者与基因阴性对照组在复发上没有差异(HR 0.93)。
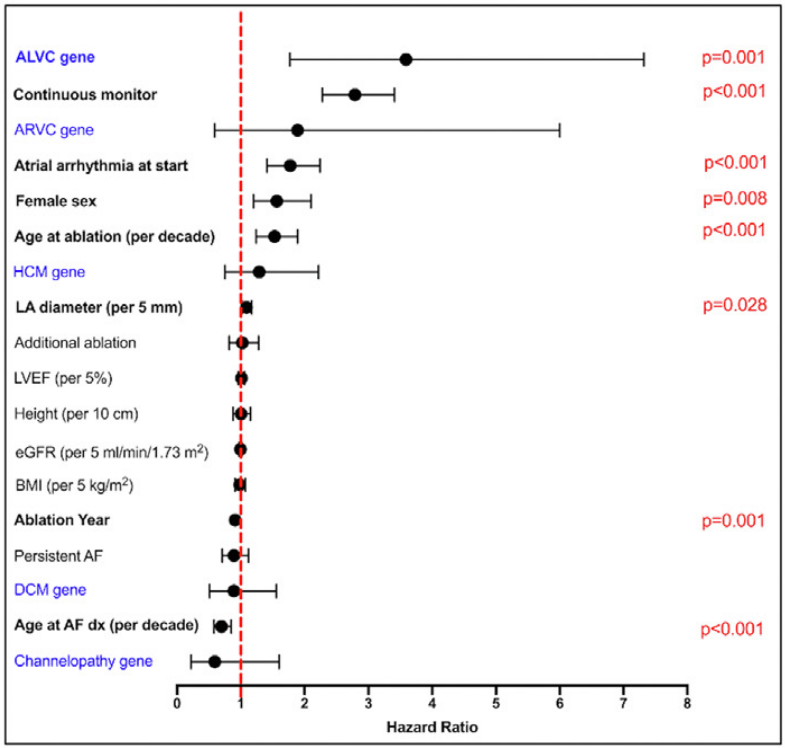
研究结论
我们的结果支持对大多数携带心肌病或心律失常基因致病性变异的患者使用AF消融术,也包括TTN基因。然而,具有ALVC的基因变异的患者,如LMNA基因,他们可能面临显著更高的心律失常复发风险。
本研究系统评估了罕见致病性基因变异对AF消融治疗的影响。研究表明,我们可以将许多关键的CM和心律失常基因归类为三种不同的消融术反应类型:
1)消融术疗效与基因型阴性对照组无显著差异(DCM基因,主要为TTN);
2) 复发风险显著增加(ALVC基因,特别是LMNA);
3) 复发风险中等或略微增加(HCM和ARVC基因)。
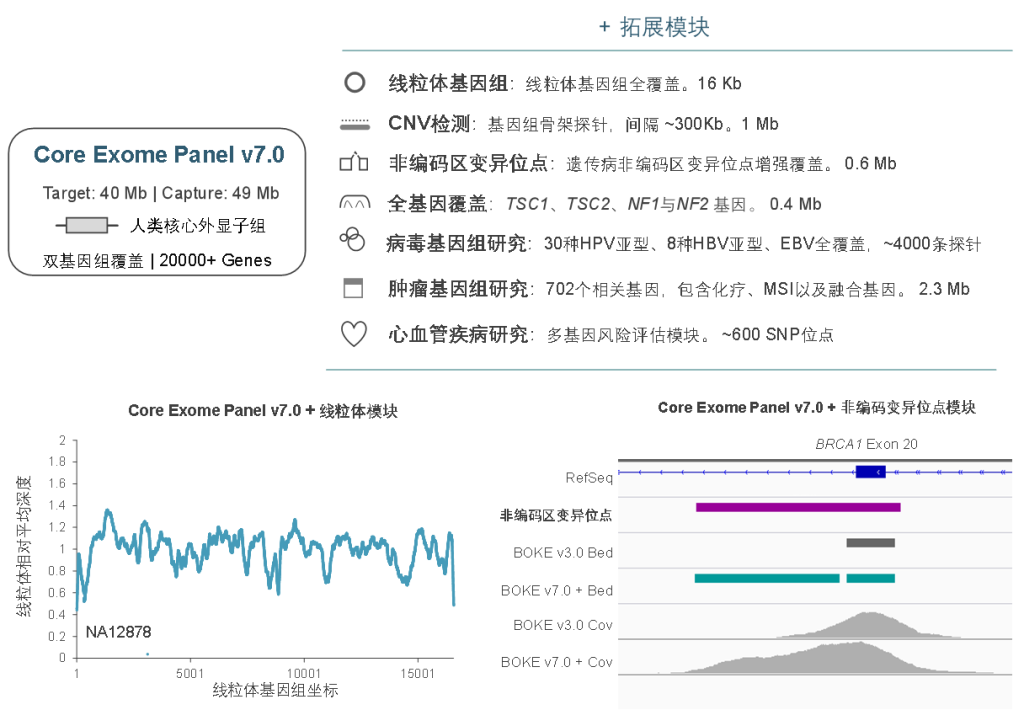
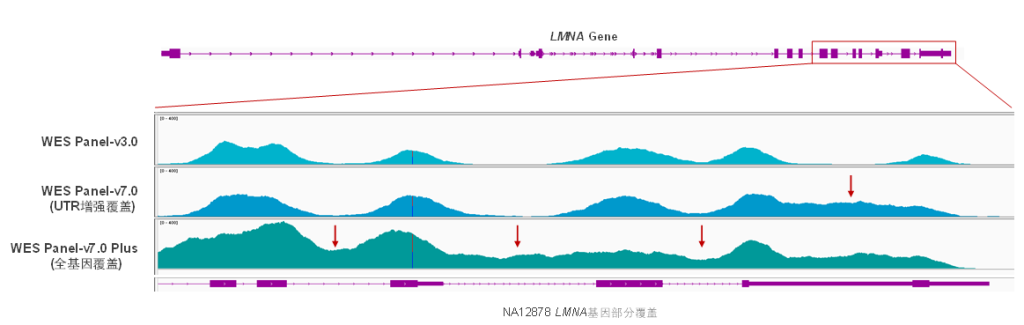
伯科WES Panel系列产品为不同科研需求提供全方位的技术支持,以LMNA基因为例,WES Panel-v3.0提供覆盖均匀的核心外显子组数据,WES Panel-v7.0增强UTR区域覆盖;再此基础上,WES Panel Plus还可以提供全基因覆盖增强等个性化补充,助力基因组学的科学研究与临床转化。
伯科全外芯片 – Core Exome Panel v3.0
TargetCap@ Core Exome Panel v3.0基于伯科高品质DNA探针合成技术开发,全流程国产制造,由~40万条探针组成,以GRCh38/hg38人类参考基因组设计,参考Refseq、CCDS、ClinVar等数据库,覆盖19,524个基因,目标区域为33.9Mb。
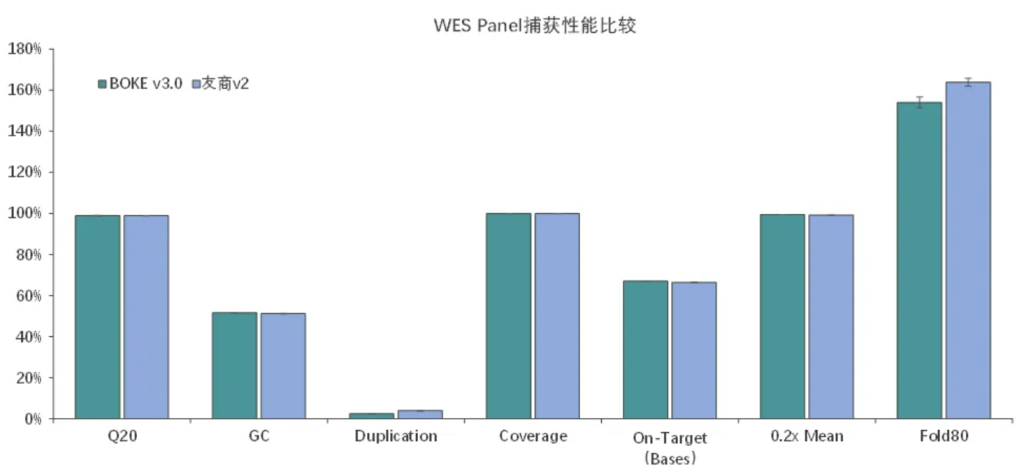
捕获性能比较
伯科全外芯片v3.0性能优异与国外友商同类型产品v2相当,中靶率、覆盖率、覆盖均一性等参数均达到国际领先水平。
适配高通量流程平台
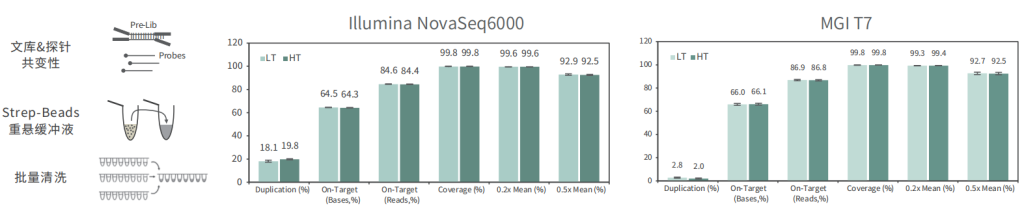
批次稳定
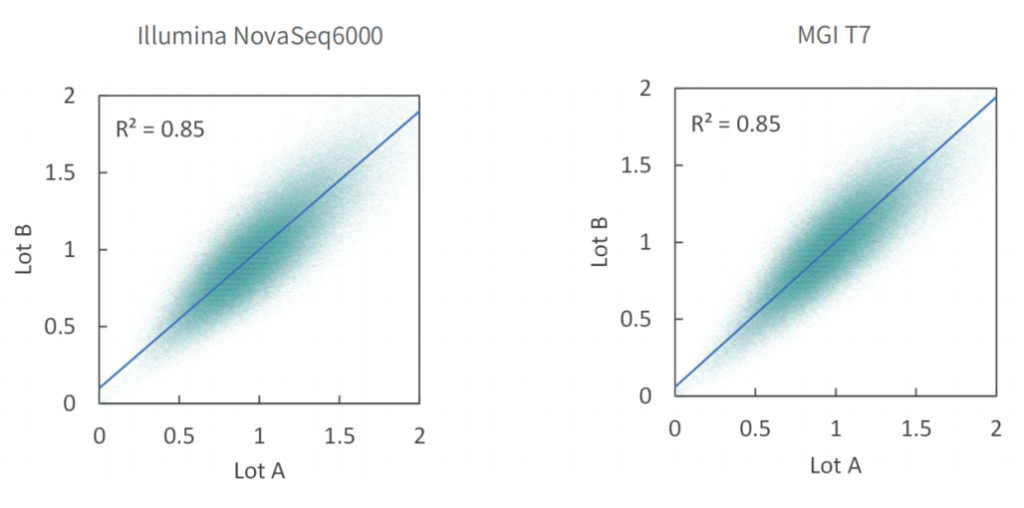
使用不同批次TargetCap® Core Exome Panel v3.0芯片对NA12878 gDNA进行捕获测序,结果显示,不同批次芯片在不同测序平台上均显示出优异的稳定性,不同位点的相对深度相关性高,批次稳定。
变异检测准确
单核苷酸变异(SNV)和插入缺失 (INDEL)是基因组变异的常见形式,也是引起人类疾病的重要原因。
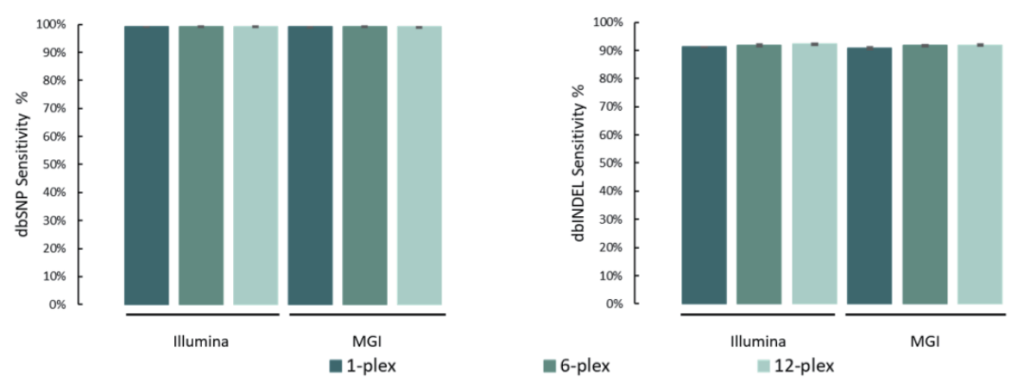
选取NA12878标准品,与预期SNV和INDEL变异进行比较。结果表明,在MGI与Illumina测序平台,SNP灵敏度为99.1%,INDEL灵敏度为91.6%。
添加线粒体模块临床样本表现
20例全血样本(S1#-S20#),采用1-4 Plex方式使用伯科Core Exome Panel v3.0添加线粒体模块进行过夜杂交捕获;其中,S1#-S10#在Illumina NovaSeq X Plus平台测序, S11#-S20#在MGI MGISEQ-T7平台测序,均采用150PE模式测序。得到测序数据后,抽取8Gb数据进行生信分析。
两种测序平台的数据表现相近,平均深度分别为111x/115x (Illumina/MGI),中靶率优异均> 85%,覆盖均一性极佳(0.2X_MD≥99.3%);仅使用8Gb数据,高达98.5%的捕获区域达到了30X以上,99.5%的捕获区域达到20X以上,为临床样本检测提供了可靠的捕获数据。
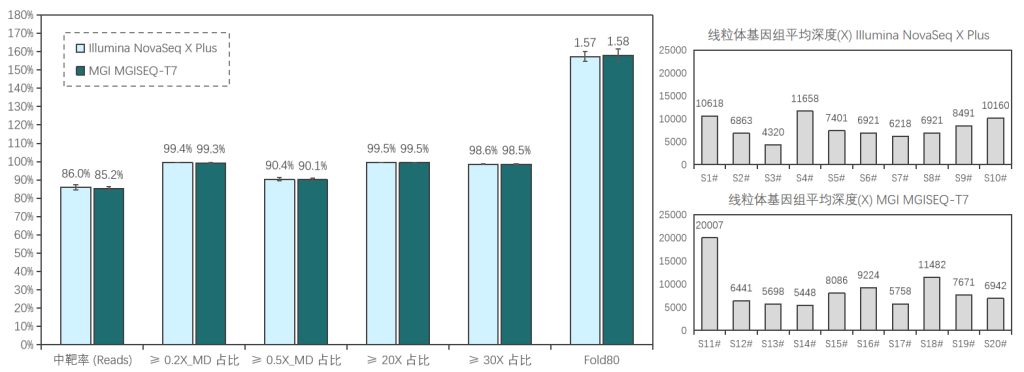
≥0.2X/0.5X_MD: Mean Depth,覆盖深度≥平均深度的0.2/0.5倍深度的区域占总区域的比例,用于表征覆盖均一性性能,越接近100%越好。
伯科全外芯片 – Core Exome Panel v7.0
Core Exome Panel v7.0(下文简称BOKE v7.0),该WES Panel增强了基因组hg19传统研究区域的覆盖,兼顾 hg19 & hg38 双版本基因组,可以更好的保证临床科研与转化的延续性。目标区域和捕获区域大小分别为40Mb和49Mb,对 hg19 传统研究区域覆盖提升至99.7%(友商I-v1),hg38传统研究区域覆盖相近(友商A-v8)。同时,新添加数百个具有一定功能与表型的基因,总基因数量达到20000+。
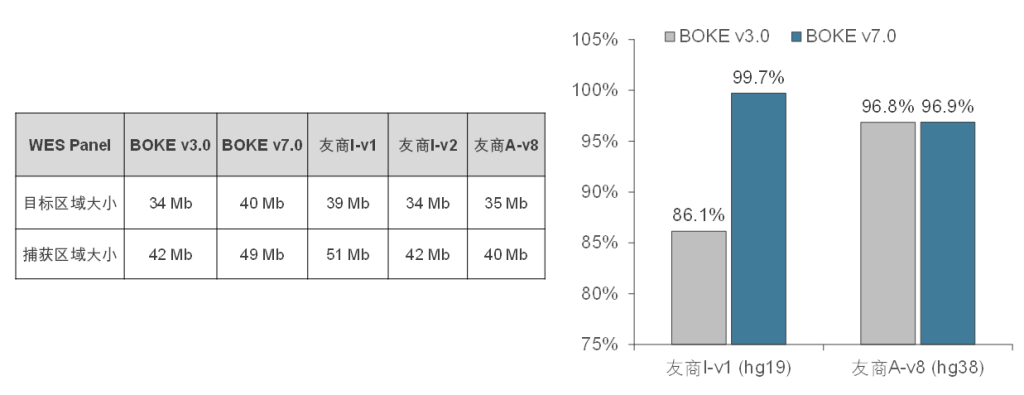
BOKE Core Exome Panel v7.0目标区域大小以及对不同友商产品目标区域的覆盖情况
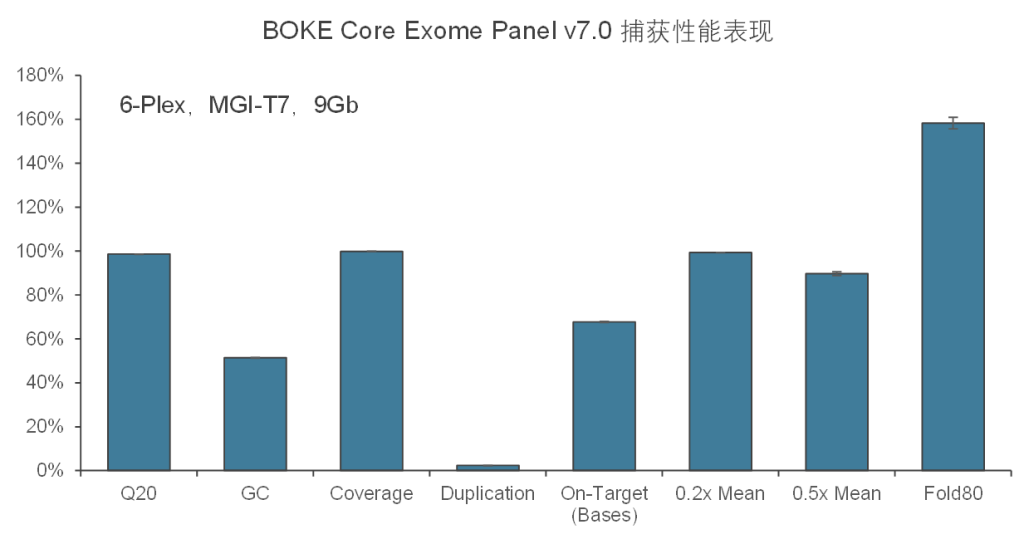
在捕获性能方面,BOKE Core Exome Panel v7.0依然表现优异,与BOKE Core Exome Panel v3.0表现相近。在测序9Gb条件下,平均深度达到110x左右,20x和30x以上区域占比分别为99.5%和98.5%,Fold 80为1.5-1.6之间,与国际领先产品数据表现相当。
同时,BOKE Core Exome Panel v7.0也可灵活的与拓展模块组合使用,满足不同场景的临床研究的需求及转化应用,包括线粒体、遗传病非编码区变异位点、单基因全覆盖、病毒基因组、肿瘤全景变异检测、重大疾病多基因风险评估模块等。此外,伯科公司自研自造的寡核苷酸合成平台可以快速响应个性化定制的需求,为人类基因组分子遗传学的研究与转化,提供更加全面高效的解决方案。