年度综述 | 基因编辑在单基因/多基因心血管疾病治疗中的应用
- boke
- 2025-08-01
- 10:00 上午

摘 要
1
引 言
心血管疾病是全球发病和死亡的主要原因,占所有死亡的三分之一以上。尽管包括药物治疗和手术治疗在内的传统治疗方法有效,但仍然迫切需要新的治疗方案。CRISPR-Cas9基因编辑技术的出现,通过允许对致病基因的DNA序列进行精确修改,提供了一种有希望的治疗方法。基因编辑促进了动物模型和人类细胞中心血管疾病的体内建模,为治疗药物的开发提供了平台。本综述考虑了CRISPR技术的当前状态及其在心血管医学中的潜在应用,同时讨论了其临床转化过程中面临的重要挑战。
2
基因编辑策略
CRISPR-Cas9,最初在原核生物的适应性免疫系统中被识别,通过Cas酶识别和切割外源核酸,Cas酶作为序列特异性的靶向蛋白和核酸酶发挥作用。在过去十年中,由于CRISPR-Cas9的精确性、可编程性和在多种细胞类型中的应用,它开启了前所未有的治疗机会。当前的CRISPR-Cas9基因组编辑工具包括核酸酶、碱基编辑器(Base Editing)和先导编辑器(Prime Editing),不仅能够进行基因修饰,还能通过CRISPR干扰(CRISPRi)和CRISPR激活(CRISPRa)进行基因调控和表观遗传修饰。此外,利用CRISPR-Cas13进行的RNA编辑作为一种修改mRNA序列的策略,也引起了人们的兴趣。
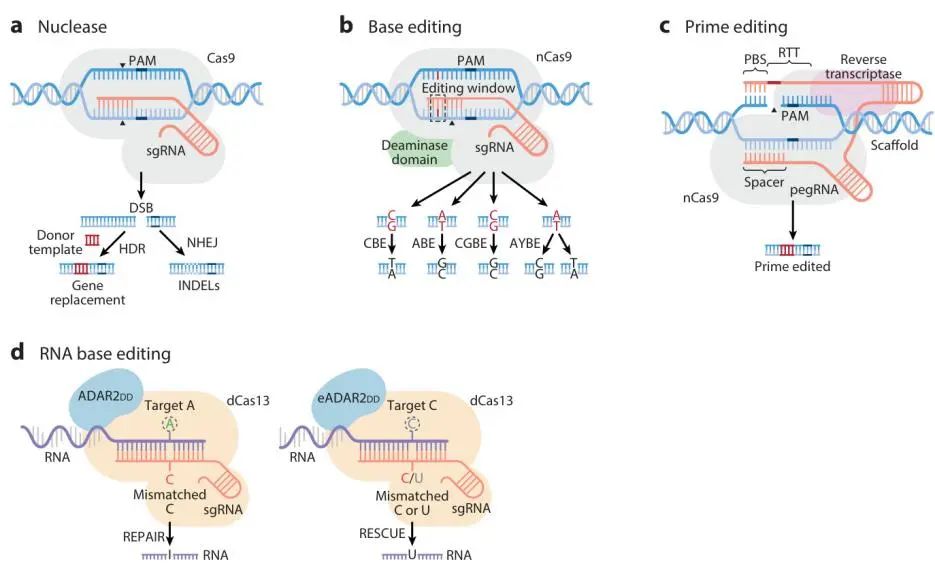
图1 基于CRISPR的基因组与转录组编辑工具。(a)CRISPR-Cas9系统由Cas9和sgRNA组成。sgRNA通过与互补DNA序列配对,将Cas9引导至特定的基因组靶点,在特定DNA位置诱导DSBs。DSBs在有供体模板的情况下通过NHEJ或HDR修复。(b)在碱基编辑中,nCas9(nickase)与脱氨酶融合以实现单核苷酸编辑。CBE诱导C-G到T-A的编辑,ABE诱导A-T到G-C的编辑。CGBE创建C-G到G-C的编辑。AYBE诱导A-T到C-G或A-T到T-A的编辑。(c)Prime编辑,允许在靶点位置引入各种DNA序列,使用PE和pegRNA进行。PE由nCas9与工程化RT融合而成。pegRNA由一个与靶点位点退火的sgRNA、nCas9的支架、用于预期编辑的RTT(逆转录模板)以及与非靶标链结合的引物结合位点(PBS)组成。(d)在RNA碱基编辑中,REPAIR系统由一个融合蛋白组成,该蛋白整合了一个作用于ADAR2DD腺苷脱氨酶的dCas13,这促进了A到I的编辑。dCas13特异性结合单链RNA,并由sgRNA引导,通过在mRNA-sgRNA双链中诱导A-C错配来指定目标A。RESCUE系统由一个融合蛋白组成,该蛋白整合了dCas13和eADAR2DD,这有助于C到U编辑。dCas13特异性结合单链RNA,并由sgRNA引导,通过在mRNA-sgRNA双链中诱导C-C或C-U错配来指定目标C。
2.1. Cas核酸酶
CRISPR-Cas9系统由Cas9核酸内切酶和单个引导RNA(sgRNA)组成。sgRNA通过与其互补的DNA序列进行碱基配对,将Cas9导向特定的基因组靶点。Cas9通过识别sgRNA互补序列附近的原间隔序列邻近基序(PAM)来识别DNA序列。位于靶点附近的PAM对于Cas9的结合和催化活性至关重要。在识别到PAM和靶序列后,Cas9在PAM位点附近的DNA上形成双链断裂(DSBs)。
传统的CRISPR-Cas9系统,通过在DNA靶序列的原间隔区诱导双链断裂(DSBs),已被广泛用于基因敲除、插入或替换。CRISPR-Cas9诱导的DSBs激活多种细胞修复机制,包括非同源末端连接(NHEJ)和同源定向修复(HDR)。NHEJ,作为主要的DSB修复途径,发生在增殖细胞和静息细胞中,涉及内源性DNA修复机制直接连接DSB末端。尽管比HDR更有效,但NHEJ易出错,常导致小插入或删除(INDELs),这些变化可能在mRNA转录本中引入移码或提前终止密码子,从而可能导致基因激活。相反,HDR是一种更精确的机制,当提供特定模板时可以替换DNA序列(图1a)。
近期研究挑战了HDR仅限于细胞周期S或G2期增殖细胞的传统观念,通过证明腺相关病毒(AAV)介导的HDR成分递送可以促进在分裂后心肌细胞中的精确靶向整合。使用高剂量AAV在心脏内递送sgRNA和修复模板促进了成年小鼠心肌细胞的HDR。另一项研究通过皮下注射AAV后,在小鼠新生心肌细胞和成熟心肌细胞中展示出有效的体内HDR,证实了上述发现。尽管仍然相对低效,这些研究表明通过HDR在成熟心脏组织中实现精确的基因校正的潜力,这表明在出生后心脏中存在未来的治疗可能性。
CRISPR-Cas9基因编辑也有潜力通过失活dominant-negative突变等位基因来治疗杂合疾病致病的错义突变。为了沉默突变体等位基因、Cas核酸酶,在sgRNA的引导下,可被定向至靶位点诱导双链断裂(DSBs),随后通过NHEJ途径进行修复。随后引入的插入或缺失(INDELs)可导致移码突变和提前终止密码子,从而产生截短的非功能性蛋白,从而沉默突变等位基因。然而,这种方法并不总是产生非功能性蛋白,某些突变等位基因可能仍保留功能。此外,这种方法需要绝对精确,以免意外沉默野生型等位基因。
2.2. Base Editing
Base Editing技术能够在不诱导双链断裂的情况下将一个DNA碱基转变为另一个碱基,从而降低插入/缺失(INDELs)和随后的移码突变风险,这些突变与双链断裂修复机制相关。Base Editing编辑器是融合蛋白,它将脱氨酶酶与nikase Cas9(nCas9)或失活型Cas9(dCas9)结合。最近有几项研究突出了Base Editing编辑器在纠正与各种心血管疾病相关的点突变方面的潜力。
最初开发了两种Base Editing编辑器,分别是C 碱基编辑器(CBEs)和A碱基编辑器(ABEs) 分别用于C:G到T:A以及A:T到G:C碱基对进行转换(图1b)。
Base Editing通过DNA结合、R环形成和靶向脱氨作用来工作。Cas9组件在sgRNA的引导下与目标DNA结合,形成一个R环,暴露出大约五个单链DNA(ssDNA)核苷酸,以便进行脱氨作用。在CBEs中,胞嘧啶脱氨酶将R环中的C转化为尿嘧啶(U),在DNA复制过程中被读取为T,从而实现精确的C到T编辑。ABEs使用脱氧腺苷脱氨酶,如TadA,将腺苷转化为肌苷(I),被读取为G,从而实现特定的A到G编辑,无需额外的修复成分。这个过程产生错配碱基对,促使DNA修复机制完成转换突变。
然而,这些编辑器不能生成颠换(Transversion)突变,如A到T或C到A的改变,这强调了开发更多碱基编辑器以引入更广泛的核苷酸替换的必要性。
最近开发的C到G的碱基编辑器(CGBEs)扩展了可能的碱基替换范围,允许在哺乳细胞中进行C到G碱基转变(图1b)。CGBEs由三个关键组件组成:nCas9、胞嘧啶脱氨酶和尿嘧啶糖基化酶(UNG),后者特异性地切除U碱基。CGBEs的效率因结构和靶位点而异,在哺乳细胞中达到高达的编辑效率,潜在的脱靶率低于。
Tong等人开发了第一个A碱基颠换编辑器(AYBE,Y:C或T),用于哺乳细胞中高效的A到C和A到T编辑(图1b)。这一创新解决了先前碱基编辑器在A到C或A到T变化中的局限性,显示出减少旁观者编辑和在不同哺乳细胞类型中的有效性。T碱基编辑器(TBEs)作为另一种碱基编辑技术已被开发,允许将T转变为C或T转变为G,从而扩大了可能进行核苷酸修饰的范围。
尽管在精确基因组编辑方面取得了显著进展,但关于潜在的脱靶效应(如编辑窗口内非目标碱基的意外修饰的旁观者编辑以及由于同源性产生的混合编辑)的担忧仍然存在。基编辑器通常在3至10个核苷酸编辑窗口内工作,修改多个核苷酸,并可能导致邻近基的意外编辑。特别是,第一代基编辑器显示出全基因组脱靶去氨化,可能导致有害的修改。例如,CBEs在小鼠胚胎中观察到脱靶C到T转换的频率比自发去氨化高20倍,同时也在人类细胞中导致广泛的转录组RNA C去氨化,影响38-58%的表达基因,编辑频率从0.07%到100%。为了解决这个问题,优化去氨化酶结构域是一个有希望的方法。例如,YE1-BE3变体减少了旁观者编辑,同时保持了高靶点效率。同样,在TadA-8e结构域中引入V106W突变显著降低了脱靶效应,从1.9%至6.7%降低至0.32%至1.3%,同时不影响靶向效率。继续针对多样化和提高精度的研究对于实现碱基编辑在治疗应用中的全部潜力至关重要。
2.3. Prime Editing
Prime Editing,一种精确且多功能的基因组编辑技术,克服了碱基编辑的限制,通过实现所有可能的核苷酸变化,包括转换和颠换。此外,Prime Editing(PEs)还能产生精确的靶向INDELs。该系统由PEs和Prime Editing引导RNA(pegRNA)组成。PEs是包含工程化逆转录酶(RT)的nCas9融合蛋白(图1 c)。pegRNA是Prime Editing系统的多功能组件,由间隔序列、nCas9支架、逆转录模板和引物结合位点(PBS)组成。间隔序列引导nCas9到达目标位点,而逆转录模板在延伸的3’端包含所需的遗传修饰。PBS与目标DNA的切点3’端杂交,启动逆转录。这种设计允许pegRNA既可指导编辑机制到达基因组目标序列,又可为RT域提供模板,产生编辑后的DNA链。因此,单个pegRNA在HDR介导的基因组编辑中同时扮演sgRNA和DNA模板的角色。此外,由于三种互补碱基配对检查点,prime editing表现出极低的脱靶效应。
近期在pegRNA设计方面的进展显著提高了prime编辑效率。具有结构化RNA基序的工程化pegRNA(epegRNA)在其3’端增强了稳定性,防止了关键成分的降解,从而在不增加脱靶编辑的情况下,提高了各种细胞类型中的编辑效率。此外,开发了如PRIDICT的生物信息学工具,根据高通量筛选数据预测pegRNA效率,从而能够高效地选择特定编辑的最佳设计。局部染色质环境会影响不同基因组位置上的prime编辑结果,导致ePRIDICT等模型的发展,这些模型展示了染色质对prime编辑的显著影响。
尽管PE在执行各种基因修饰方面具有多功能性,但其编辑效率低于碱基编辑器,尤其是在体内。因此,在设计策略时,既要考虑所需的编辑效果,也要考虑所需的编辑效率,这对于治疗的有效性至关重要。值得注意的是,对于某些病理状况,即使是相对较低的编辑效率也可能足以产生治疗效益。在DMD小鼠模型中,15%的编辑效率已显示出潜在的治疗效果。这强调了根据每种疾病背景定制基因编辑方法的重要性,即在编辑的精确性和可实现的效率之间取得平衡。
2.4. 使用CRISPR干扰和CRISPR激活进行基因调控
CRISPR-Cas9也可以通过CRISPRi调节基因表达,使用dCas9抑制基因表达而不在DNA中造成DSBs。CRISPRi系统由dCas9和sgRNA组成,与目标基因的启动子区域或开放阅读框结合,通过破坏转录因子的结合或阻碍RNA聚合酶活性来抑制转录。为了提高哺乳动物细胞中的基因沉默效率,将KRAB融合到dCas9的C端,与单独的dCas9相比,显著提高了基因沉默效果。表达dCas9-KRAB和sgRNA的双重AAV8s有效地沉默了成年小鼠肝脏中的Pcsk9,这是一种关键的胆固醇调节因子。这种干预措施显著降低了治疗后的血清Pcsk9和胆固醇水平,持续至治疗后的24周。
CRISPRa利用与转录激活剂融合的dCas9来增强基因表达而不改变DNA。该系统将dCas9-激活剂复合物引导到特定的基因组位点,通常靶向所需基因转录起始位点上游的区域。通过招募转录体,CRISPRa有效地增加了内源性靶基因的转录活性。已开发了各种融合蛋白,如dCas9-VP64和dCas9-VPR(VP64、p65和Rta的融合蛋白),以优化激活效率并显著提高基因表达水平。
尽管具有潜力,对CRISPRi和CRISPRa在治疗应用中的研究不如Base编辑和prime编辑广泛。这很可能反映了更精确的基因编辑工具引入永久性基因组改变的能力,而CRISPRi和CRISPRa可能总体上效果较差,并且需要长期表达以实现持续的疗效应用。
2.5. RNA编辑
尽管DNA编辑技术在取得显著进步的同时,非目标编辑的意外情况仍然是一个担忧,对治疗应用存在重大风险。与DNA编辑相比,CRISPR-Cas13的RNA编辑提供了安全性优势,因为它具有暂时性且避免永久性可遗传变化,从而降低了持久性意外效应的风险。这种RNA修饰的暂时性在需要快速调整基因表达而不产生长期后果的条件下尤其重要。此外,与Cas9不同,Cas13在目标位点不需要PAM序列,这为靶点选择提供了更大的灵活性。基于dCas13的RNA编辑系统能够在转录水平上进行编辑,而不在DNA中引入DSBs,从而提高了它们的安全性特征。在RNA碱基编辑中,由dCas13和作用于ADAR2DD的腺苷脱氨酶组成的融合蛋白,促进了RNA水平的A到I或C到U的该百年 [REPAIR和RESCUE(系统](图1d)。
尽管具有这些优势,RNA编辑仍面临挑战,例如相对较低的编辑效率,这受到sgRNA和目标RNA的二级结构的影响。此外,在表达水平非常高的基因中,例如心脏特异性收缩基因,即使基因组水平的编辑效率较低,也可能由于这些基因的高表达而在转录水平上引起显著变化。这种放大效应在直接对转录本进行修改的RNA编辑中并未观察到。此外,尽管RNA编辑具有短暂性,但脱靶效应仍然是一个重大担忧。
3
心脏病的遗传学
心血管疾病根据潜在突变的性质分为单基因病和多基因病。
单基因病,如DMD、家族性肥厚型心肌病(HCM)和扩张型心肌病(DCM),是由单个基因中的致病性突变引起的,允许通过基因组编辑针对受影响组织中的这些特定突变。
多基因病,包括冠状动脉疾病和心力衰竭等常见疾病,是由多个遗传和环境因素引起的。这些疾病的治疗策略侧重于编辑非致病基因,引入有益的变体或保护性修饰。本节介绍了代表性遗传性心血管疾病及其在人类细胞和动物模型中相应的基因编辑策略。
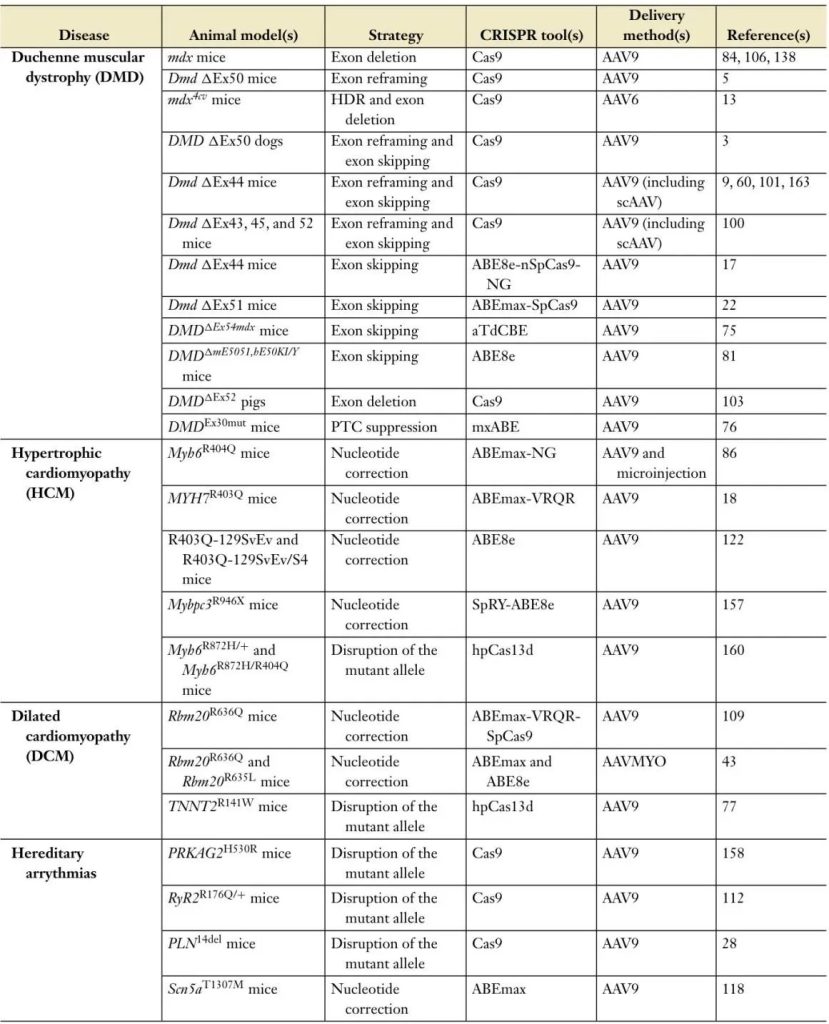
3.1. 杜氏肌营养不良症
DMD是一种严重的X连锁遗传性疾病,以进行性肌肉萎缩和心脏受累为特征。它主要影响年轻男性,诊断通常发生在3至5岁之间。几乎所有患者到18岁时都会出现心脏受累,导致早逝。目前尚无治愈方法,治疗方法主要集中于减轻症状和提高生活质量。
DMD是由抗肌萎缩蛋白基因(DMD)突变引起的,该基因编码肌特异性膜蛋白-抗肌萎缩蛋白,它是维持肌纤维完整性的关键蛋白。抗肌萎缩蛋白在肌纤维收缩期间充当减震器,将肌动蛋白细胞骨架与收缩装置连接起来。
DMD 基因跨越 2.2 Mb 并包含 79 个外显子,是人类最大的基因之一,这导致了其高突变频率和患者中观察到的突变多样性。突变包括缺失(68.8%)、重复(11.2%)、点突变(10.4%)和 小型缺失重复(9.6%)。
外显子跳跃是一种有希望的策略,用于恢复抗肌萎缩蛋白的表达,允许绕过错位的外显子并翻译蛋白质的必需C端。美国食品药品监督管理局(FDA)批准的oligo核苷酸介导的外显子跳跃疗法针对DMD患者外显子45、51或53中的突变。这些药物调节前体信使RNA(premRNA)的剪接,以产生截断但部分功能性抗肌萎缩蛋白。然而,它们需要每周进行静脉注射,并且在没有显著表型改善的情况下导致截断抗肌萎缩蛋白表达水平低。此外,虽然这些治疗可能减缓肌肉功能的下降,但它们并不代表一种治愈方案,患者功能能力的长期改善尚未明确证实。因此,在全面解决DMD患者需求方面仍存在挑战。
CRISPR-Cas9基因编辑技术为纠正DMD中的致病突变提供了有希望的途径,可能为改善疾病的多种病理表现提供永久性治疗方案。DMD的治疗策略主要集中在编辑产后肌肉细胞中的DMD基因,主要使用AAV9递送CRISPR组分,以在体内测试治疗效果。
初期研究部署AAV9递送Cas9和一对sgRNAs,靶向外显子23的3’和5’端,导致外显子23跳跃,恢复开放阅读框和DMD小鼠模型中抗肌萎缩蛋白表达的恢复。我们实验室的研究进一步证明了CRISPR-Cas9基因编辑在犬DMD模型中的有效性,使用AAV9递送组分,在心脏中达到92%的抗肌萎缩蛋白水平恢复。此外,通过系统递送AAV9和CRISPR-Cas9组分,将外显子45在缺少外显子44的DMD小鼠模型中重排,导致终身抗肌萎缩蛋白表达和肌肉耐用性增强。稳定的基因修正和18个月内的最小脱靶效应突显了其作为DMD持久治疗策略的潜力。
最近的研究扩展了DMD编辑策略的范畴,使其应用于碱基编辑器。采用优化的ABE技术,干扰了DMD中外显子50的供体位点,利用AAV9 断裂内含肽反式剪接系统进行更大载体的递送,导致外显子51的跳过和功能性抗肌萎缩蛋白的表达。此外,还报道了使用工程化CBE进行DMD碱基编辑以及在一个人类化DMD小鼠模型中的碱基编辑。同时,一种基于Prime Editing的方法被用来重新构建DMD外显子52,通过在外显子序列中精确插入两个核苷酸,恢复了阅读框,并使人类诱导的多能干细胞来源的心肌细胞(iPSC-CMs)能够产生功能性抗肌萎缩蛋白。
最近的一项研究证明了基因编辑在猪DMD模型中的有效性。此外,还构建了一个带有外显子4和46突变的长臂猿DMD模型,这两个外显子位于DMD突变热点区域。这些在大动物模型中的进展突显了更好地模拟人类DMD病理潜力,为治疗开发提供了更深入的见解。
RNA碱基编辑也被提议作为DMD的治疗策略。一种由mini-dCas13X介导的RNA编辑系统(mxABE)在老鼠身上实现了高达84%的A到I编辑,在多个肌肉组织中将抗肌萎缩蛋白的表达恢复到正常水平的50%以上。与膈肌和胫骨前肌相比,心脏中抗肌萎缩蛋白的表达显著恢复,3周后AAV9系统性注射后水平约为正常水平的60%,6周后下降到20%到40%,6个月后进一步下降到2%到4%。抗肌萎缩蛋白表达随时间下降的原因尚待确定,但代表了潜在的治疗问题。有趣的是,RNA中的A到I突变在整个期间都得到了维持。这些发现强调了在基因编辑后维持治疗性抗肌萎缩蛋白表达的复杂性,即使在高编辑效率下,同时也突出了RNA编辑作为可行的治疗策略的潜力。
3.2. 肥厚型心肌病
HCM(Hypertrophic Cardiomyopathy),最常见的遗传性心脏病,涉及左心室肥厚,可能导致心力衰竭、心律失常和猝死)。除了心脏移植外,没有治愈HCM的方法。尽管心肌肌球蛋白抑制剂可以部分缓解疾病表型,但它们的使用仅限于特定患者群体,并且可能会降低收缩功能,甚至可能加剧心力衰竭。
HCM表现出显著的遗传和临床异质性,主要由肌小节蛋白基因突变引起,使其成为基因编辑的重要靶点。
MYH7基因编码β-肌球蛋白重链蛋白,与35%至40%的基因型阳性HCM病例有关。与人类不同,在人类中,MYH7是主要的心脏肌球蛋白,而小鼠中则主要是异构体Myb6。
多项研究表明,携带Myb6中的致病突变R404Q或MYH7中的R403Q的小鼠HCM表型可以通过AAV9递送碱基编辑器来校正相应的突变而得到缓解。AAV9递送碱基编辑器校正了小鼠胚胎中的Myb6R404Q,证明了有效缓解HCM表型的效果。同样,Chai等人使用HCM患者的iPSC-CMs和人类化小鼠模型针对MYH7R403Q进行靶向,发现通过AAV9递送ABE显著缓解了新生小鼠的HCM相关病理表现。
在另一项研究中,使用AAV9包装的ABE纠正了两种HCM小鼠模型R403Q-129SvEv和R403Q-129SvEv/S4中的R403Q突变,分别代表隐匿型和快速发作表型。在10-13天大时进行AAV9-ABE注射显著降低了两种模型中的疾病表型。相比之下,通过Cas9核酸酶介导的突变等位基因沉默产生了有害后果,突出了ABE Base Editing系统在HCM治疗中的优势。
MYBPC3是另一个导致HCM的基因,Wu等人证明在Mybpc3R946X小鼠模型中给予AAV9-ABE成功改善了HCM表型,包括心脏肥大和功能障碍,DNA水平上的编辑效率为9.56%。
近期研究证实了RNA编辑在DMD和HCM中的有效性。Yang等开发了一种高精度CRISPR-Cas13d系统(hpCas13d),该系统能够选择性地靶向HCM中的突变Myh6 RNA。通过在出生后第3天通过皮下注射1×1011vg的AAV9载体至HCM小鼠模型的心肌细胞中,他们实现了对突变Myh6的等位基因特异性抑制,而不影响正常基因,有效地防止了体内的心脏肥大(图2)。
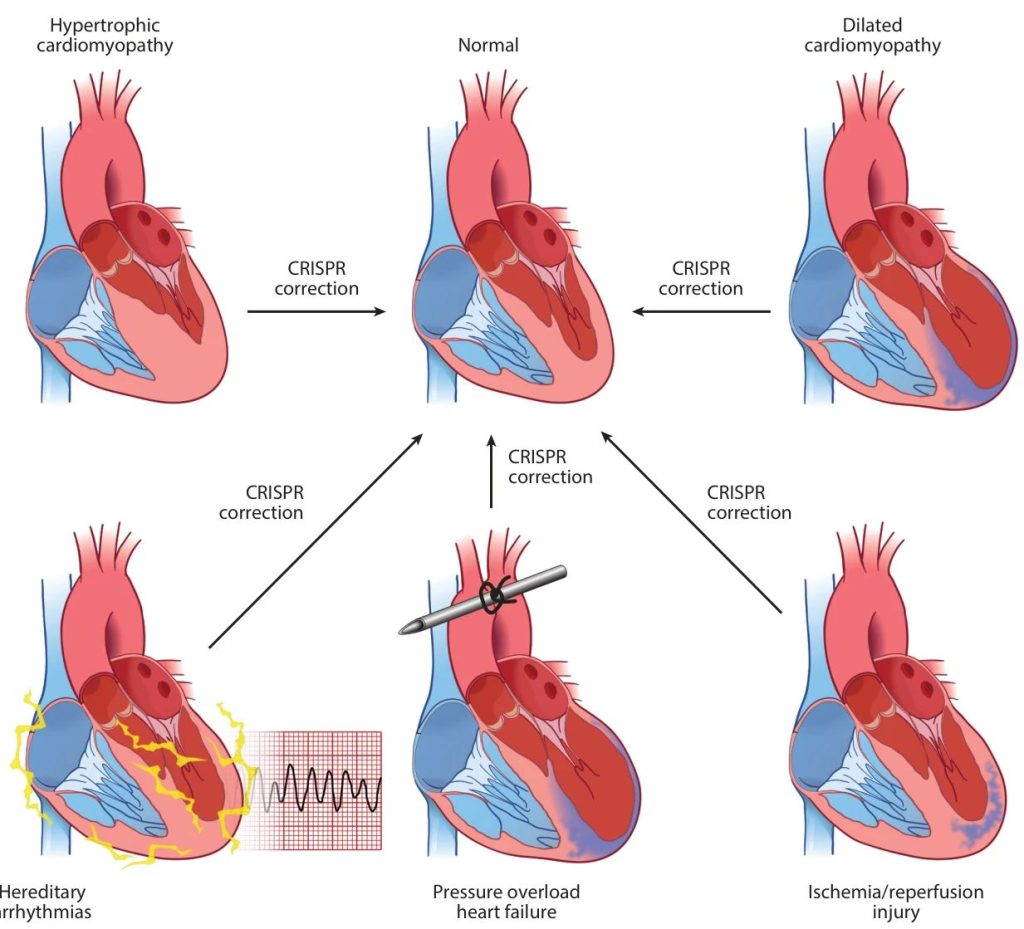
图2 利用 CRISPR 系统治疗单基因和常见心血管疾病的策略示意图。在单基因疾病,例如肥厚性心肌病、扩张性心肌病和遗传性心律失常中,致病变异导致蛋白质表达异常或基因缺失。然后,靶向基因编辑工具进行校正,最终目标是开发基因编辑治疗策略。在常见疾病,例如缺血再灌注损伤和压力负荷性心力衰竭中,CRISPR 技术可用于诱导有针对性的蛋白质表达,从而抑制致病信号。这项技术不仅能敲除特定基因,还能精确调控蛋白质活性。
3.3. 扩张型心肌病
DCM(Dilated Cardiomyopathy)是一种渐进性疾病,以心室,尤其是左心室增大和收缩功能障碍为特征,而左心室是心脏的主要泵。这导致心脏输出量减少,可能引发心力衰竭、心律失常和猝死。与HCM一样,DCM除了心脏移植外没有治愈治疗方法。DCM与超过40个基因突变有关,这些基因编码对心肌功能至关重要的蛋白质。RBM20的常染色体显性突变与一种特别侵袭性的DCM有关,占家族性DCM病例的2%至6%。
近期研究表明,基因编辑技术在解决扩张型心肌病(DCM)方面具有潜力。Nishiyama等人成功利用Base Editing和Prime Editing针对导致DCM的致病性RBM20突变,重点关注几个突变:人类iPSC-CMs中的R634Q和R636S,以及严重DCM小鼠模型中的R636Q(这与人类中的R634Q突变相当)。使用ABE校正R634Q恢复了适当的剪接模式和RBM20蛋白的正确核定位。此外,Prime编辑在体外有效校正了R636S突变,扩展了可靶向突变的范围。在具有严重DCM表型的同源R636Q突变小鼠模型中,出生后第5天通过AAV9介导的ABE递送恢复了心脏收缩并缓解了DCM表型,在cDNA水平上实现了66%的编辑效率。同样,Grosch等人使用ABE在心肌细胞中恢复了75%的RBM20核定位,显著提高了具有增强心脏趋向性的AAVMYO的编辑效率。此外,使用AAV9载体进行Cas13b RNA介导的治疗成功挽救了患有TNNT2基因R141W/+突变心肌病(DCM)小鼠的表型。尽管没有具体提及治疗效果的持续时间或脱靶效应,但这种方法能够有效地在体内特异性敲低突变型TNNT2(R141W)转录本(图2)。
3.4. 遗传性心律失常
遗传性心律失常是由离子通道基因突变引起的,代表了一组重要的遗传性心脏疾病,这些疾病导致了18%的猝死。目前,治疗措施主要涉及β-阻滞剂和可植入式心脏转复除颤器(ICDs),这些干预措施显示出部分有效性。
近期研究突出了CRISPR介导技术在体内治疗遗传性心律失常中的潜力。例如,携带PRKAG2H530R突变的敲入小鼠,该突变与家族性Wolff-Parkinson-White(WPW)综合征相关,接受了AAV9-sgRNA和AAV9-Cas9的系统递送,以破坏突变基因并减轻心律失常表型。此外,CRISPR-Cas9被用于通过产后第10天AAV9递送纠正ryanodine receptor 2(RyR2)中的R176Q/+突变,成功预防了儿茶酚胺介导的多形性室性心动过速(CPVT)。在另一项研究中,编码CRISPR-Cas9成分的AAV9特异性靶向了人源化phospholamban(PLN)-R14del成年小鼠中的R14del等位基因,这些小鼠表现出与恶性心律失常相关的扩张型心肌病。这种干预显著改善了心脏功能并降低了心律失常的易感性。此外,AAV9递送ABE纠正了长QT综合征3型(LQT3)小鼠模型中sodium voltage-gated channel alpha subunit 5 (Scn5a)中的T1307M突变。此治疗方法减轻了QT间期延长,并降低了出现心律失常的风险,包括扭转型室速和室性心动过速(图2)。
3.5. 通过编辑致病信号通路阻断心血管疾病
纠正致病突变,这些突变通常具有异质性且发生频率低,限制了它们的广泛应用。此外,单个基因往往存在多个突变,需要不同的基因编辑策略。考虑到针对单个基因突变所涉及的努力和成本,为单个基因突变开发单独的基因编辑策略是不切实际的,这突显了需要更全面的基因编辑方法,该方法可以同时针对多个突变。不是纠正特定的突变,而是通过改变由各种突变激活的关键致病信号通路,可以扩大单一策略的适用范围。值得注意的是,这种方法可以通过修改非致病基因来引入有益变体或保护性改变,应用于常见的非遗传性疾病。
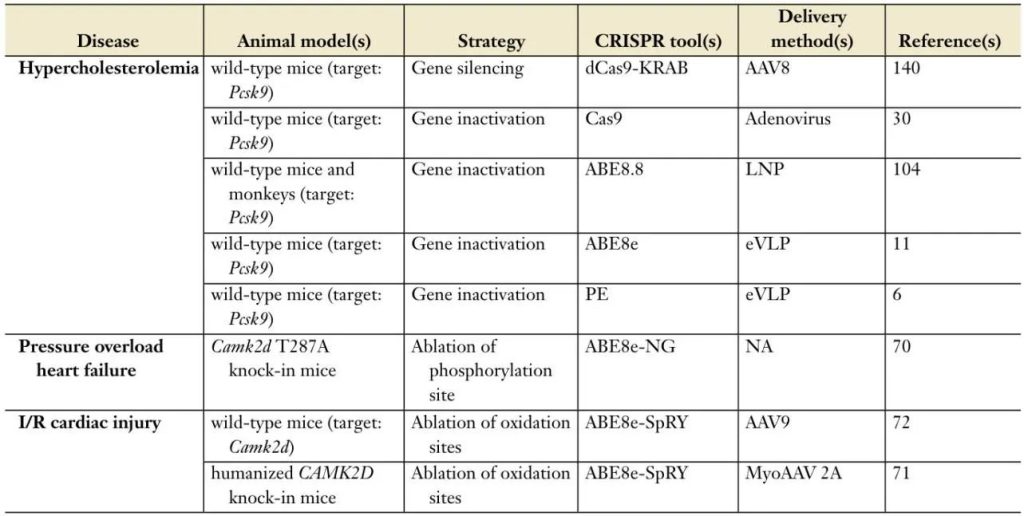
高胆固醇血症,以低密度脂蛋白胆固醇(LDL-C)水平升高为特征,是动脉粥样硬化性心血管疾病,包括心肌梗死的主要危险因素。虽然遗传因素,如家族性高胆固醇血症(FH),在某些病例中起着关键作用,但生活方式选择,如饮食和体育锻炼,也对胆固醇水平有显著贡献。
在肝细胞合成的PCSK9在胆固醇代谢中至关重要,并且是新型高胆固醇血症治疗的关键靶点。PCSK9中罕见的获得功能突变已被确立为FH的致病因素。相反,PCSK9中的失活变异在2%-3%的特定民族群体中发生,与较低的血浆LDL-C水平相关,并且可以显著降低冠心病风险而不会产生不良影响。
基于CRISPR的基因编辑技术的最新创新通过针对PCSK9实现了高胆固醇血症的新治疗策略。VERVE-101,一种基于CRISPR的新型基因编辑疗法,在早期临床试验中显示出希望。这种单次静脉注射含有sgRNA和ABE的脂质纳米颗粒(LNPs)旨在永久性地失活肝细胞中的PCSK9,可能为难以治疗的家族性高胆固醇血症患者提供长期解决方案。这种方法可能在不持续用药的情况下提供持久的LDL-C降低,解决遗传性和生活方式引起的家族性高胆固醇血症。
另一种干预心脏疾病致病途径的策略是干扰在病理条件下激活的主要信号通路。CaMKIIδ通过破坏Ca2+稳态,并触发炎症或凋亡信号和纤维化,导致各种心脏疾病,包括缺血/再灌注(I/R)损伤、心力衰竭、心脏肥大和心律失常。因此,调节CaMKIIδ活性是治疗各种心脏疾病的有希望的疗法。
CaMKIIδ在激活时发生氧化和磷酸化。为了破坏其病理性激活,构建了一种抗磷酸化型Camk2d T287A小鼠模型,该模型表现出对压力过载诱导的心脏保护作用。携带CAMK2D T287A突变的iPSC-CMs也免受β-肾上腺素应激的影响(图2)。
同样,一个对氧化激活具有抵抗性的CAMK2D突变体对I/R损伤表现出心脏保护作用。对氧化敏感的蛋氨酸(M281V和M282V)的编辑赋予了人类iPSC-CMs对I/R刺激的最大心脏保护。AAV9介导的编辑组件向成鼠I/R损伤后的递送增强了心脏功能,并减少了细胞凋亡和纤维化。
为了临床转化,开发了一种人源化的CAMK2D敲入小鼠模型。通过具有高效心肌转导的载体MyoAAV 2A在I/R损伤后心脏内注射编辑组件,表现出心脏保护作用(图2)。
这些通过基因编辑阻断病理信号传导的例子表明,这种方法有进一步的应用潜力。
某些心脏疾病,如心肌炎和Takotsubo心肌病,通常是短暂的,通常在恢复后不需要长期治疗。因此,一旦疾病治愈,基因校正突变的必要性就会降低。然而,这些永久性基因改变在恢复后的生理状态上的长期影响仍了解甚少。因此,必须谨慎考虑基因编辑治疗的选择。需要进一步研究来评估这些干预措施在长时间内对细胞稳态和全身功能的影响(表1)。
此外,iPSC技术和CRISPR-Cas9基因编辑技术的结合为个性化医学开辟了新的可能性。患者特异性的细胞模型使研究人员能够在更相关的背景下评估潜在疗法的有效性和安全性,可能带来更精准和有效的治疗。
表1 CRISPR介导的基因编辑策略总结,以挽救体内心血管疾病表型
4
心血管疾病CRISPR基因编辑模型
高通量测序技术的出现,包括全外显子测序(WES)和全基因组测序(WGS),极大地扩展了我们识别与心血管疾病相关的遗传变异的能力。这些方法揭示了众多变异,如单核苷酸多态性、插入、缺失和结构变异,这些变异可能与心脏疾病有关。然而,区分致病突变和良性变异变得复杂。
CRISPR-Cas9技术允许研究特定变异及其在心血管疾病中的作用。本节探讨了CRISPR-Cas9技术在两个关键实验平台上的应用:诱导多能干细胞及其衍生的心肌细胞和鼠模型,以纠正和研究心血管疾病。
4.1. 人类诱导多能干细胞及其诱导多能干细胞来源的心肌细胞
成熟心肌细胞的固有后分裂特性对分析人类心脏组织提出了重大挑战。人类诱导多能干细胞(iPSCs)的发展克服了这一限制,并提供了可再生和可扩展的心脏细胞来源。iPSCs为在体外研究人类心血管疾病提供了一个强大的平台,通过使患者特异性的基因型和表型在多种细胞类型中得以复制,特别是在iPSC-CMs中。
CRISPR-Cas9基因组编辑为心脏疾病建模和表征遗传变异提供了有用的工具。这项技术为心脏疾病建模提供了两个关键应用。
一种方法涉及创建经过校正的iPSC系,这些系仅在感兴趣的位点上与原始患者来源的突变iPSC系不同,从而允许在没有混淆因素的情况下精确研究特定的遗传改变及其表型后果。
另一种方法是将致病突变引入野生型iPSCs,产生具有与野生型iPSCs相同遗传背景的突变系,以模拟患者突变。这对于研究罕见的遗传变异或创建疾病细胞模型非常有价值,这些疾病的患者来源的iPSCs不可用。CRISPR-Cas9在iPSC基础的心脏病建模中的应用显著提高了我们对各种心血管疾病,包括通道病和心肌病的理解。
4.2. 小鼠模型
自2013年首个CRISPR-Cas9修饰的鼠模型被开发以来,这项技术已实现了敲除和敲入鼠模型的快速高效生成。传统的基于胚胎干细胞(ES)细胞的方法需要漫长的培养过程,单个基因修改可能需要超过一年,而CRISPR-Cas9可以将时间缩短到几个月,以直接编辑受精卵。此外,CRISPR-Cas9允许同时编辑多个基因,而这在ES细胞中由于定位和验证每个修改的复杂性而具有挑战性,往往导致嵌合体。这种效率和多功能性使得创建复杂的遗传模型成为可能,加速了我们对于心血管遗传学的理解。
CRISPR-Cas9技术的进步使得在老鼠中实现更精细的心脏特异性基因编辑方法成为可能。Carroll等人开发了表达SpCas9的转基因老鼠,其受心脏特异性α-肌球蛋白重链(Myh6)启动子控制。他们通过腹腔注射编码靶向Myh6基因的sgRNA的AAV9,实现了高效的基因编辑,成功抑制了Myh6的表达,导致心脏衰竭。在另一种方法中,生成了表达Cre诱导的Cas9-P2A-GFP融合蛋白的Rosa26-Cas9-GFP老鼠。向新生老鼠注射编码sgRNA和由cTnT启动子驱动的Cre的AAV9,实现了心肌细胞特异性的CRISPR-Cas9基因编辑。
此外,如第3.2节和3.3节所述,我们实验室通过系统注射编码sgRNAs和分裂型碱基编辑器(在cTnT启动子控制下)的双AAV9,成功进行了心脏特异性碱基编辑。这种方法有效地纠正了导致扩张型心肌病(DCM)和肥厚型心肌病(HCM)的Rbm20和MYH7突变。
重要的是,这项技术通过用人类遗传序列替换包含特定外显子或突变的特定基因组区域,实现了人源化小鼠的开发。这种方法允许在活体中使用人类基因组编辑工具,但不能预测潜在的脱靶或未预期的编辑事件。这种能力对于针对导致疾病突变的“热点”区域尤为重要,可以更全面地评估基因组编辑策略的特异性和安全性。
物种间,小鼠和人类基因型-表型差异是转化研究中的重要考虑因素。例如,RBM20突变在携带杂合突变的人类中会导致严重的扩张型心肌病(DCM)表型,而小鼠通常需要纯合突变才能表现出类似的表型。这种差异可能归因于物种特有的生物差异,例如小鼠中存在冗余途径或补偿机制,以减轻单个突变等位基因的影响。确实,小鼠的遗传变异比人类更大。这些物种间变异不仅限于基因型-表型关系,还包括基因表达模式、代谢途径以及生理参数(如心脏大小和心率)的差异。因此,在mouse模型中显示有效性的治疗干预措施可能由于这些生物差异而无法直接应用于人类。此外,mouse模型通常通过使用单个基因突变来简化疾病机制,而人类病理学是由复杂的遗传和环境相互作用引起的。这种方法论限制降低了小鼠研究对人类治疗学的预测价值。为了弥合这种种间差距并提高临床前研究的转化潜力,大型动物模型正变得越来越重要。这些模型提供了与人类相似的生理和解剖特征,可能在临床环境中提供更准确的疗效预测。
5
基因编辑的挑战
基因组编辑技术现在开始应用于临床环境中的患者,临床试验正在进行中。然而,实现临床应用仍面临一些挑战,例如合适的递送策略和潜在的脱靶效应。
5.1. 递送挑战
基因组编辑组件的递送仍然是治疗应用中的主要障碍。AAV由于其安全性剖面和在不同组织中的高转导效率,目前是用于递送治疗剂的病毒载体中最广泛应用的。然而,AAV面临几个限制。AAV载体固有的包装容量限制,大约为4.7 Kb,为递送SpCas9及其相关的sgRNA带来了重大挑战。这一限制迫使人们开发双载体系统,其中Cas9和sgRNA组件被分别包装。或者,使用了断裂内含肽反式剪接系统,允许将Cas9蛋白分割并使用两个AAV载体递送。然而,由于两个组件都需要进入细胞以完成系统的完整重组,编辑效率可能会受到影响。
此外,这些方法通常需要更高的病毒剂量,这可能导致潜在的卡迪奥毒性和其他不良反应。在DMD的临床试验中,使用的AAV剂量通常在5X1013至2X1014vg/kg之间,突出了达到治疗效果所需的病毒载量。为了减轻这些限制,使用适合单个AAV的较小Cas变体是一种选择。这降低了病毒剂量和生产成本,但通常会导致编辑效率降低。Self-complementary AAV(scAAV)可以使病毒剂量降低至原来的1/20以达到有效递送,并且比单链AAV DNA更耐降解。然而,scAAV较小的包装容量(<2.4 kb)限制了其在sgRNA递送中的应用。
衣壳蛋白修饰是一种有希望的途径来提高腺相关病毒(AAV)的转导效率。近期的研究已经探索了多种策略来改造AAV衣壳以提高心脏和肌肉的靶向性。在成年小鼠中筛选了183种AAV变体,确定了AAVMYO,一种具有改进效率和肌肉组织特异性(包括心脏)的突变型AAV9衣壳。Tabebordbar等开发了MyoAAV,一类新的AAV衣壳,它显示出在转导肌肉组织和心脏方面具有优异的效率选择性。重要的是,AAVMYO和MyoAAV的改进转导效率允许在保持治疗效果的同时降低病毒剂量,可能减轻剂量相关的副作用。
宿主免疫反应仍然是AAV基因治疗中的重大障碍。对AAV衣壳和转基因产物的先天性和获得性免疫反应可能导致AAV被消除,从而降低其治疗效果。由于先前接触野生型AAV或既往治疗,人体内存在的抗体可以中和系统性递送的AAV,阻止其进入靶细胞,对其实际临床应用造成主要障碍。此外,中和抗体的过量水平可能导致不良免疫反应,包括促炎细胞因子分泌增加和补体激活,这可能使治疗结果复杂化。
为了解决AAV介导的基因治疗中的宿主免疫反应,已经开发出几种策略。血浆置换术,可以去除循环抗体,包括针对AAV的中和抗体,可以增强AAV向靶细胞的递送。然而,这种方法存在一些挑战,如需要多次会话、抗体库容易替换(抗体反弹效应)以及使患者易受感染。免疫抑制剂,包括皮质类固醇,可以控制对AAV介导的基因治疗的免疫反应,但也会增加感染或病毒复发的风险。通过修改AAV衣壳蛋白以改变表面表位,也可以帮助逃避免疫检测,使工程化衣壳不易被预先存在的抗体识别,从而提高递送和疗效(图3a)。
基因编辑策略在目标基因中创建DNA双链断裂(DSB)会因AAV在目标位点的整合而引发重大的安全问题。为了解决AAV载体在递送基因组编辑组件方面的局限性,应探索替代的递送方法。
脂质纳米颗粒(LNPs)相较于AAV具有多项优势,如大容量包装,允许递送mRNA、蛋白质或核糖核酸蛋白(RNPs)。优化LNPs的大小、形状、包覆和表面化学可以提高其疗效,而无需预先存在的免疫力。此外,与AAV相比,LNPs更经济高效,更适合大规模生产。LNPs可实现瞬时表达,从而减少脱靶编辑,并因免疫原性较低而允许多次给药。重要的是,LNPs的递送已在临床试验中取得成功。然而,尽管具有潜在优势,LNPs的递送效率比AAV显著较低。尽管LNPs在肝脏中表现出有效的递送,但它们对心脏的递送却受到限制,部分原因是心肌细胞上缺乏有助于纳米颗粒渗透的独特细胞表面标记。因此,为了以便有效地将纳米颗粒输送至包括心脏,例如,在内的难到达的目标器官,需要进一步改进纳米颗粒的特性(图3b)。
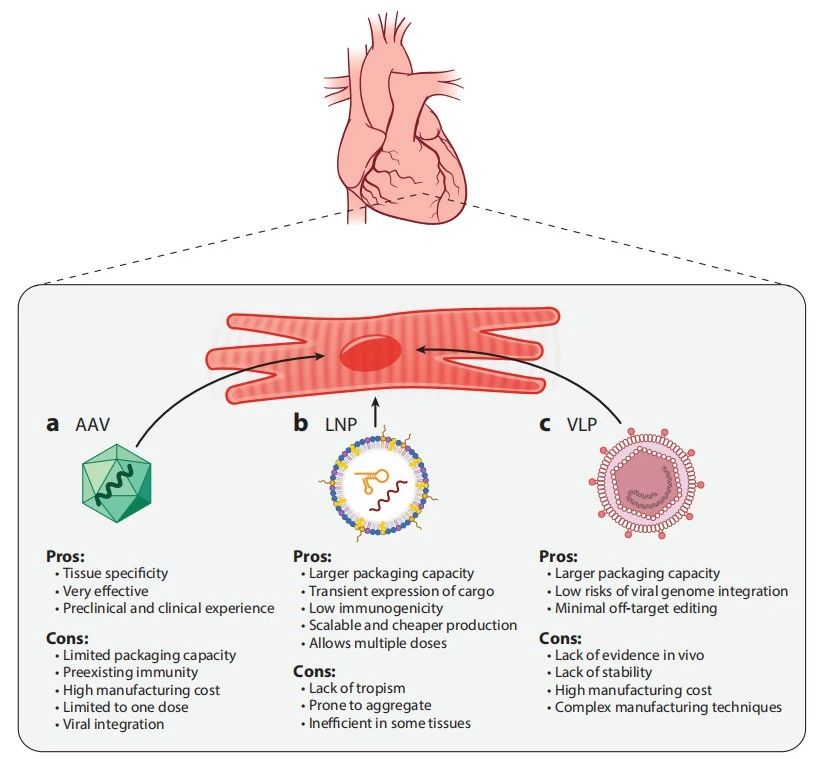
图3 基因编辑组件在心肌细胞中的各种递送策略比较。
病毒样颗粒(VLPs)是递送基因编辑组件的有前景的选择。这些自我组装的非感染性结构模仿病毒颗粒的形态和大小,但缺乏病毒基因组,为mRNA、蛋白质或RNA颗粒的递送提供了高包装能力,具有最小的脱靶效应和低病毒基因组整合风险。大多数用于mRNA或蛋白质递送的VLP结构源于逆转录病毒,因为它们呈球形且缺乏刚性结构对称性。最近,开发了用于在多种组织中高效进行体内碱基编辑的工程病毒样颗粒(eVLPs)。具体来说,一种针对Dnmt1的eVLP碱基编辑器,通过新生小鼠的脑室注射实现了53-55%的编辑效率,成功地在Dnmt1中安装了一个沉默突变。针对Pcsk9的靶向实现了肝脏组织的63%编辑,并在成年小鼠的眼眶静脉注射后,血清Pcsk9蛋白水平降低了78%。在rd12小鼠遗传性盲模型中,视网膜下腔注射ABE8e-NG-eVLPs纠正了21%的Rpe65的R44X突变,部分恢复了视觉功能。此外,一种优化的VLP(PE-eVLP)实现了体内prime editor的有效递送。eVLP编辑器在新生小鼠脑室内注射后,在Dnmt1位点引入了4个碱基的替换,得到了47%的编辑。它还实现了Rpe65中R44X突变7.2%的纠正,并在rd12小鼠模型中部分恢复了视觉功能。
VLPs具有病毒和非病毒递送技术的关键特性,使它们成为增强基因组编辑治疗潜力的有希望策略。然而,为了实现其临床应用,必须解决几个挑战。一个显著挑战是重组颗粒的稳定性,这对于在储存和递送过程中维持其完整性和功能至关重要。与AAVs相比,VLP递送缺乏实质性证据,特别是有效递送到心脏组织。此外,VLPs在体内的安全性需要进一步表征,以确保其适用于治疗应用。此外,VLPs的制造成本高,且过程复杂(图3c)。
总结来说,向体内靶器官和细胞递送基因编辑器的几种方法正在涌现,它们各有优缺点。非病毒递送策略的持续优化代表着未来研究的一个重要领域。
5.2. 脱靶效应
人类基因组编辑疗法在临床应用中面临的主要障碍是安全担忧。在利用CRISPR-Cas9技术纠正心血管疾病时,解决脱靶和脱器官效应至关重要,尤其是在心脏,脱靶突变可能导致致命的心律失常事件,甚至来自少量心肌细胞的意外突变。
最近的研究开发了多种全基因组无偏好的脱靶事件识别方法,包括GUIDE-seq、Extru-seq、DISCOVER-Seq+和Tracking-seq)。全基因组测序(WGS)是检测人类脱靶突变最全面的方法,允许直接比较基因编辑前后的基因组序列。然而,检测低频脱靶事件所需的高成本和灵敏度带来了重大限制。此外,鉴于基因组编码区和特别是非编码区的个体序列变异,基于代表性基因组的研究很难全面预测大量患者可能的脱靶基因编辑。
此外,细胞中持续的Cas9表达可能导致非目标修饰,特别是在终身基因编辑策略中。因此,精确控制Cas9活性是理想的。已经探索了各种策略来实现系统的条件性调节,包括小分子激活、小分子抑制、细胞特异性启动子、生物响应性递送载体、基因调节以及光、热、超声波和/或磁激活CRISPR-Cas9系统的化学和物理策略。尽管这些方法提供了潜在的解决方案,但每种方法都有其局限性。除了调节Cas9活性的各种策略外,抑制CRISPR-Cas系统的抗-CRISPR(Acr)蛋白提供了一种有效控制基因编辑的手段。这些蛋白可以抑制Cas9,减少非目标修饰,但它们自身存在一些局限性,如体积大、潜在的毒性和Acr蛋白的免疫原性。
单基因疾病的复杂性,更不用说多基因疾病,再加上潜在的意外基因组改变,使得预测永久性基因修改的后果变得复杂。这种不确定性因我们对基因-环境相互作用随时间变化的有限理解而加剧,可能导致意外的表型后果或病理学。尽管RNA编辑在理论上可以实现可调节性和可逆性,而不会产生永久性的脱靶效应,但在许多RNA编辑策略中已经观察到大量的转录组脱靶效应。
5.3. 基因编辑组件可能引发的免疫反应
来自细菌的CRISPR系统引发了该疗法的潜在免疫原性担忧。虽然免疫原性并不一定严重,但它会影响疗法的安全性和有效性。很多研究表明,许多人已经对Cas9存在获得性免疫反应。例如,分别有58%和78%的人血样中检测到了针对SpCas9和SaCas9的抗体。CRISPR成分甚至在没有获得免疫的人身上也能引发体液和细胞免疫反应。Hakim等的研究表明,在犬类杜氏肌营养不良症模型中,肌肉注射和静脉注射含有CRISPR成分的AAV8和AAV9,导致产生针对Cas9的抗体和细胞毒性T细胞(CTL)反应。
为了应对这些挑战,研究人员已部署了多种策略,包括免疫抑制、针对Cas9的调节性T细胞的调节以及抑制Cas9的免疫反应。基因治疗临床试验中的免疫反应对研究产生了很大影响,突显出对免疫原性更低的CRISPR疗法需求。
6
展望心血管基因编辑的未来
心血管治疗设备随着创新技术的进步而显著发展,然而,在药物治疗方面,心血管疾病的临床格局相对停滞。尽管多年来心血管研究中确定了众多潜在的治疗靶点,但临床现实是,传统的药物,如抗血小板药物、利尿剂、β-阻滞剂和血管紧张素转化酶(ACE)抑制剂,仍然是药物治疗的基础。
基因编辑技术为治疗遗传性疾病提供了新的治疗可能性,有可能改变人类心血管疾病的治疗方法。FDA最近批准了首个用于治疗镰状细胞性贫血的CRISPR药物,凸显了这项技术在治疗遗传疾病方面的潜力,为心血管应用铺平了道路。然而,CRISPR技术的临床转化面临着几个挑战。一个主要问题是确定心肌细胞基因校正的最佳治疗窗口,因为基因组编辑在心脏病中的疗效可能取决于疾病进展的阶段。例如,出生后第5天接受治疗的纯合子 Rbm2OR636Q 小鼠在心脏功能方面的改善与杂合子小鼠相当,表明早期干预可能带来更大的益处。这强调了及时治疗策略的重要性,因为早期校正突变可能增加恢复正常心脏功能的可能性。此外,随着心脏疾病的进展,相关的纤维化、炎症浸润和心肌细胞死亡会降低基因递送的有效性。
临床获益最佳的心肌细胞编辑百分比尚未确定,且可能因目标基因和具体突变而异。在此基础上,CRISPR-Cas9介导的利用AAV载体进行的心脏编辑带来了额外的复杂性。这种方法可能导致基因修饰的镶嵌模式和不完全的基因敲除。这种在心肌细胞中的镶嵌基因校正可能潜在地导致心脏的电生理异质性,从而增加心律失常的风险。具有不同遗传组成的细胞可以表现出不同的电生理特性,可能破坏心脏的电活动协调。此外,编辑细胞对相邻未编辑心肌功能障碍的代偿性重塑也存在可能性。
人类心肌细胞的核多倍性性质带来了另一个挑战。因此,为了完全纠正疾病,可能需要编辑多个心肌细胞核,这降低了整体效率。从根本上讲,心脏在一生中的持续功能强调了理解该器官基因组编辑长期影响和安全性至关重要的意义。除了技术挑战外,CRISPR技术的临床转化还引发了关于超出治疗目的的基因修改的伦理担忧。该技术的复杂性和潜在不良事件的不可预测性,为从患者那里获得知情同意带来了挑战。此外,CRISPR技术的实施可能导致治疗成本增加,从而可能限制其可及性。
我们预期,通过科学与技术工作者的持续努力,科学技术的进步终将克服这些障碍。通过仔细克服这些挑战并利用每一种新的方法,我们可能会很快就会见证一个在治疗单基因和多基因心血管疾病方面实现精准治疗的时代。
参考资料
Gene Editing Applications as Future Cardiovascular Therapies. Annu. Rev. Genet. 2025. 59:5.1–5.27


