促衰老与抗衰老基因介绍(四):CDKN2A/B 基因簇及其相关分子在多种疾病中的作用与研究进展
- boke
- 2025-08-29
- 2:51 下午
CDKN2A/B 基因簇(含 CDKN2A、CDKN2B 及长链非编码 RNA CDKN2B-AS1/ANRIL)位于人类染色体 9p21.3 区域,是细胞周期调控、衰老进程及疾病发生的关键分子节点。其异常(如突变、缺失、甲基化或表达失调)不仅与肿瘤密切相关,还参与心血管疾病、神经退行性疾病、代谢性疾病及衰老相关疾病的病理机制。
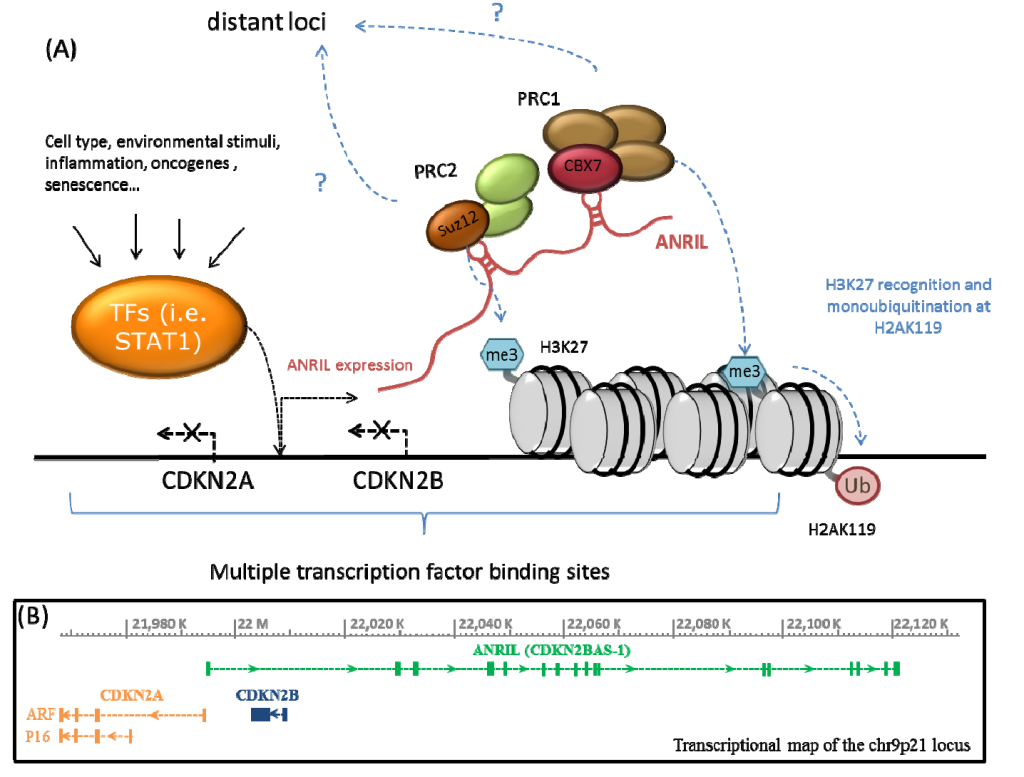
一
CDKN2A/B 在肿瘤中的作用与机制
CDKN2A/B 作为经典抑癌基因,其功能缺失(纯合缺失、突变、甲基化)是肿瘤发生发展的核心驱动事件之一,涉及脑癌、白血病、食管癌、尿路上皮癌等多种类型,且具有疾病特异性的分子机制与临床意义。
1.1 脑癌:多组学机制与预后分层
脑癌(如低级别胶质瘤 LGG、多形性胶质母细胞瘤 GBM)的发病与 CDKN2A/B 及相关分子的遗传 – 表观调控密切相关。
Zheng Ye 等 [1] 通过多组学分析(eQTL、mQTL、haQTL 等)发现,SNP rs615552_AL359922.1 与 CDKN2A、CDKN2B 及 CDKN2B-AS1 显著共定位,通过调控这些基因的表达影响脑癌发生;且 CDKN2B-AS1 主要在恶性细胞和树突状细胞(DCs)中表达,分别关联 DNA 修复通路和抗原呈递基因,提示其在肿瘤免疫与抑癌网络中的双重作用。此外,甲基化位点 cg14069088(CDKN2A)是 LGG 的独立预后因子,但对 GBM 无显著影响 [1],表明 CDKN2A 甲基化的预后价值具有肿瘤亚型特异性。
在儿童胶质瘤中,J. Foss-Skiftesvik 等 [5] 通过多血统全基因组关联研究(GWAS)证实,9p21.3 位点的 CDKN2B-AS1 常见变异(如 rs573687)与儿童星形细胞瘤(最常见胶质瘤亚型)显著相关(OR=1.273,P=6.974e-10),且该关联由低级别星形细胞瘤驱动,与脑组织中 CDKN2B 表达降低直接相关 [5]。这一发现首次确立了儿童神经肿瘤中常见变异的全基因组显著证据,为儿童胶质瘤的遗传易感性研究提供了关键依据。
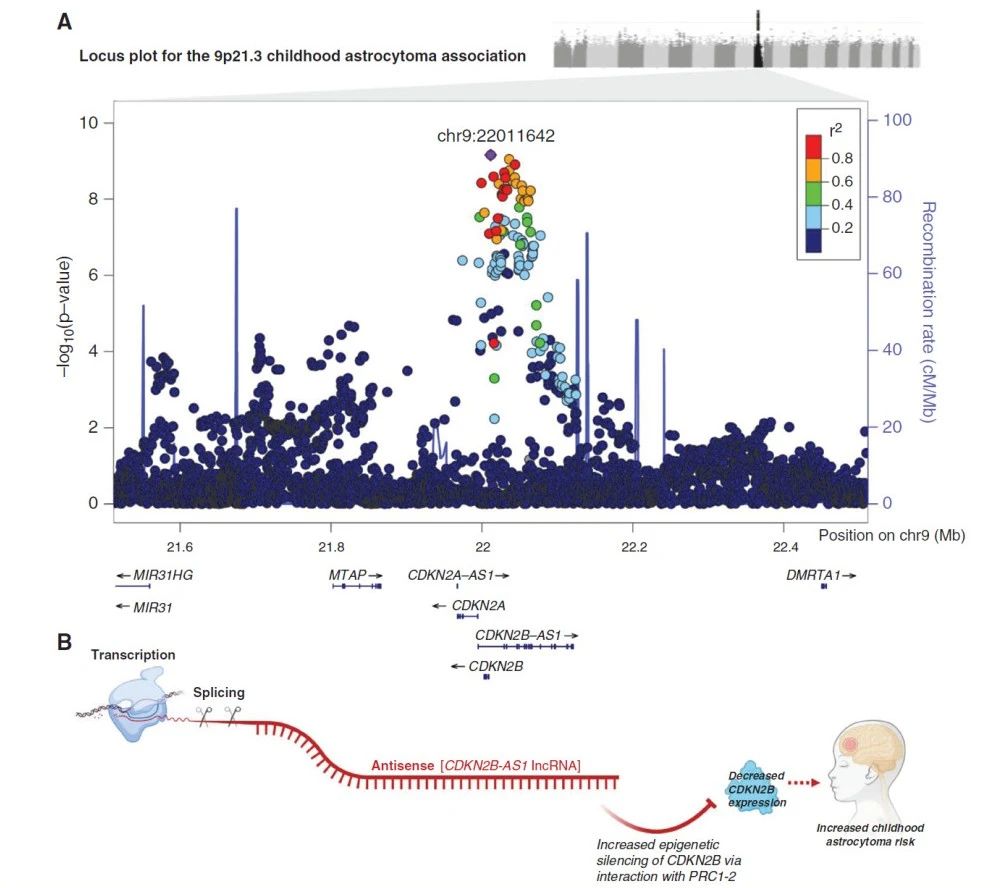
Fig. Detailed locus plot for the 9p21.3 astrocytoma association.
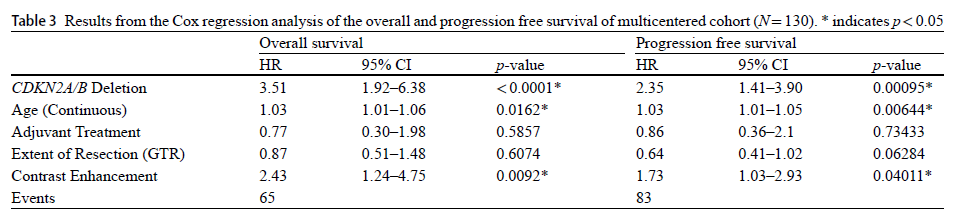
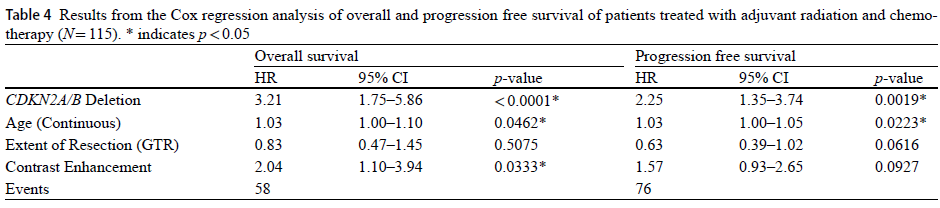
对于 IDH 突变型星形细胞瘤,Wetzel EA 等 [25] 的多中心研究证实,CDKN2A/B 纯合缺失是独立的不良预后因子:伴 CDKN2A/B 缺失的患者中位总生存期(OS)仅 5.0 年、无进展生存期(PFS)3.0 年,显著差于仅组织学 4 级患者(OS 10.1 年、PFS 5.0 年);且术前对比增强可进一步预测该类患者的更差结局(OS HR=2.19,P=0.0090)[25]。基于此,2021 年 WHO 中枢神经系统肿瘤分类将 CDKN2A/B 缺失列为 IDH 突变型星形细胞瘤归为 4 级的独立分子标准,无需依赖组织学分级 [25],彻底改变了脑胶质瘤的分型与预后评估体系。
1.2儿童急性淋巴细胞白血病:种族特异性与剪切调控
儿童急性淋巴细胞白血病(ALL)的易感性与 CDKN2A/B 多态性密切相关,且存在显著种族差异。
Maryam Aghasipour 等 [3] 对 22 项病例对照研究(10203 例 ALL、36424 名对照)的荟萃分析显示,CDKN2A 的 rs3731217 变异对 ALL 具有保护作用(OR 降低),但仅在高加索人和非洲人后裔中显著,亚洲裔儿童中无此关联;而 rs3731249 变异则与儿童 ALL 易感性显著相关,且无明显种族差异 [3]。这提示 CDKN2A 多态性的疾病影响存在人群特异性,可能与不同种族的遗传背景差异相关。
在儿童 B 细胞前体 ALL(BCP-ALL)中,E. Hungate 等 [11] 发现 9p21.3 位点的 rs77728904 变异与疾病易感性独立相关(P=3.32×10−15,OR=1.72),且其关联机制涉及 CDKN2A/B 的剪切调控:rs3731217 通过作用于 CDKN2A 外显子 3 的剪切调控元件影响基因功能(P=0.01),而 rs662463(该区域的潜在致病变异)作为 CDKN2B 的顺式 eQTL,通过 CEBPB 信号调控 CDKN2B 表达,风险等位基因与 CDKN2B 低表达相关,进而增加 BCP-ALL 风险 [11]。这些发现揭示了 CDKN2A/B 在 ALL 病因中的剪切调控机制,为疾病风险分层提供了分子依据。

Fig. Haploview LD map of the 9p21.3 locus showing differences in the LD structure by ancestry in 1,000 Genomes Phase 1 populations.
1.3 食管癌:情境依赖性作用与治疗启示
CDKN2A 在食管癌(尤其是食管腺癌 EAC 及其癌前病变巴雷特食管 BE)中的作用具有显著情境依赖性。
Piyali Ganguli 等 [23] 结合基因组、转录组及临床数据发现,尽管 CDKN2A 是经典抑癌基因,但在 BE 中其缺失可通过 “反向选择” 后续 TP53 突变,反而抑制 EAC 的发生;而在 EAC 中,CDKN2A 与 9p21 区域其他基因的共缺失则通过影响细胞周期、氧化磷酸化及干扰素应答,预测患者不良生存(HR 升高)[23]。机制上,CDKN2A 缺失可抑制鳞状上皮维持,促使细胞获得侵袭性表型,且 IFNE(9p21 区域共缺失基因)的缺失会减少 BE 中的免疫浸润,但对 EAC 无此影响 [23],进一步证实 CDKN2A 作用的情境特异性。
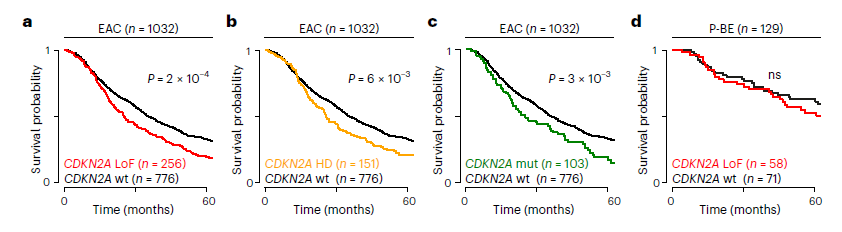
Fig. Effect of the LoF of CDKN2A and other 9p21 genes on survival.
基于上述文章发现,2025年ASCO的Post Staff [19] 将基础研究成果转化为临床管理策略,填补 CDKN2A 在 BE 患者风险分层中的应用空白。研究发现:临床转化视角,提出 “CDKN2A 缺失状态可指导巴雷特食管(BE)患者分层”—— 早期 BE 伴 CDKN2A 缺失但无 TP53 突变者,年度癌变风险 < 0.1%,可延长随访间隔;患者管理建议:CDKN2A/TP53 双缺失的 BE 患者需每 3 个月内镜监测,且优先纳入化学预防试验;流行病学数据:OCCAMS 联盟 350 例 BE 患者中,CDKN2A 缺失者占 18%,其中仅 9% 进展为食管腺癌(EAC),远低于 CDKN2A 野生型患者(23%)。
在食管癌诊断中,Chongchang Zhou 等 [16] 对 42 项研究(2656 例 EAC、612 例癌前病变)的荟萃分析显示,CDKN2A 甲基化频率随癌变进程显著升高:EAC vs 对照(OR=12.60,P<0.001)、EAC vs BE(OR=2.89,P<0.001)、BE vs 对照(OR=7.38,P<0.001);且 CDKN2A 甲基化与肿瘤分级(OR=1.79)、临床分期(OR=2.56)相关,诊断 EAC 的特异性达 96%、曲线下面积(AUC)0.83,血液样本的 AUC 更高达 0.90 [16]。这表明 CDKN2A 甲基化可作为食管癌早期诊断的潜在生物标志物,尤其适用于无创液体活检。
1.4 其他肿瘤:致病机理、治疗预测与耐药机制
在晚期尿路上皮癌(aUC)中,T. Jindal 等 [24] 对 UNITE 研究 170 例接受恩诺单抗 – 维汀(EV)治疗患者的分析显示,CDKN2A/B 突变与 EV 疗效显著相关:携带 CDKN2A 突变的患者中位 PFS 仅 4.6 个月(vs 野生型 6.0 个月,P=0.024),CDKN2B 突变患者中位 PFS 4.4 个月(vs 野生型 6.0 个月,P=0.008),多变量分析证实 CDKN2A/B 突变是 EV 治疗 PFS 缩短的独立预测因子 [24]。这一发现为 aUC 患者的 EV 治疗选择提供了分子标志物,有助于避免无效治疗。
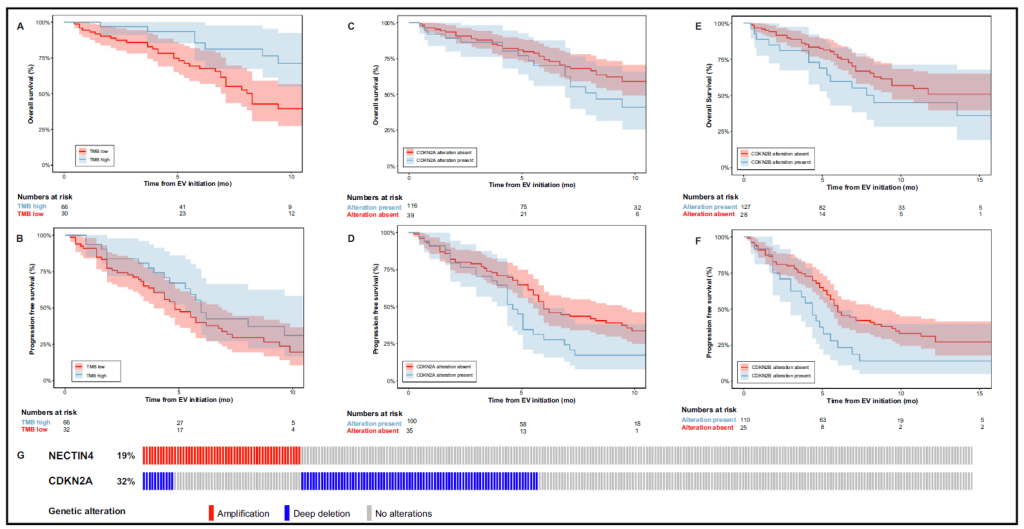
Fig. Survival outcomes for patients with and without relevant biomarkers and an oncoprint showing the relationship for NECTIN4 and CDKN2A.
在肝内胆管癌中,Liu K 等 [12] 报道 1 例 CDKN2A/B 缺失患者接受帕博西尼(CDK4/6 抑制剂)联合仑伐替尼治疗的案例:患者术后复发伴多器官转移,基因检测提示 CDKN2A/B 缺失,治疗 12 个月后颅内肿瘤完全消失、右肺转移灶缩小,PFS 达 32.2 个月、OS 34.4 个月 [12]。该案例证实,CDKN2A/B 缺失可作为 CDK4/6 抑制剂疗效的预测标志物,为胆管癌的精准治疗提供了新方案。
二
CDKN2A/B 在心血管疾病中的作用
CDKN2A/B 及相关长链非编码 RNA(如 CDKN2B-AS1/ANRIL)是心血管疾病(如心肌梗死、动脉粥样硬化、早发性心血管病)的关键遗传调控因子,其多态性与疾病易感性、病理机制密切相关。
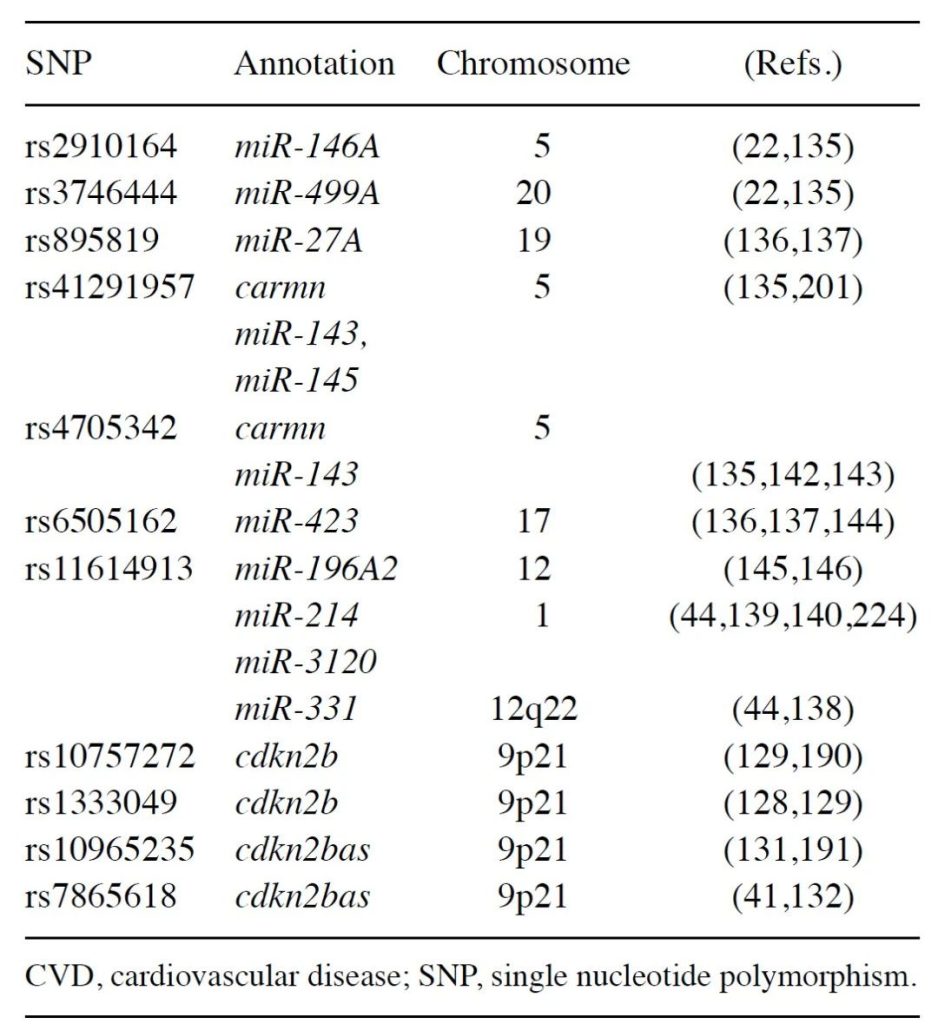
H. Giral 等 [10] 在 2018 年的研究中,通过整合 GWAS 数据发现,与冠心病(CAD)及 cardiometabolic 性状相关的遗传变异中,约 80% 位于非编码区域(如基因间区、内含子),这些区域富集了长链非编码 RNA(lncRNA)、环状 RNA(circRNA)等功能性非编码 RNA [10]。其中,9p21.3 区域的 ANRIL 作为典型 lncRNA,其与 CDKN2A/B 的调控关系并非个例 —— 该研究还发现,多个 CAD 相关非编码 RNA(如 MIAT、CARMN)可通过顺式或反式作用调控血管细胞(内皮细胞、VSMC)的增殖与衰老 [10]。此外,该研究强调,现有数据库(如 GTEx、FANTOM)对非编码 RNA 与 SNP 关联的整合不足,未来需通过单细胞测序、CRISPR 筛选等技术,进一步验证非编码 RNA 在心血管疾病中的因果作用 [10]。
2.1 2型糖尿病合并心肌梗死:遗传标志物、精准分层与治疗
在 2 型糖尿病(T2DM)患者中,CDKN2B-AS1 的多态性与心肌梗死(MI)风险显著相关。
2019 年发表的一项综述 [9] 指出,全基因组关联研究(GWAS)已识别出 200 余个 T2DM 易感位点,但仅少数位点(如 CDKN2B-AS1 所在的 9p21.3 区域)被证实与疾病病理生理直接相关(如影响胰岛素分泌、胰岛素抵抗)[9]。该综述提出,CDKN2A/B 相关多态性虽未被列为 T2DM 的核心易感位点,但其通过调控细胞周期影响胰岛 β 细胞增殖能力,可能间接参与 T2DM 进展,为 T2DM 遗传预测提供了新的潜在靶点 [9]。
Miha Tibaut 等 [7] 对 1071 例斯洛文尼亚 T2DM 患者(334 例 MI、737 例无冠心病)的研究显示,CDKN2B-AS1 的 rs1333049 多态性 C 等位基因在 MI 患者中频率更高(P=0.05);共显性模型中,CC 基因型患者的 MI 风险显著升高(AOR=1.50,95% CI 1.02-2.21,P=0.04),隐性模型中 CC 基因型同样关联 MI 风险增加(AOR=1.38,95% CI 1.09-1.89,P=0.04)[7]。这表明 rs1333049 的 C 等位基因和 CC 基因型可能是斯洛文尼亚 T2DM 人群 MI 的遗传标志物,为疾病风险分层提供了依据。
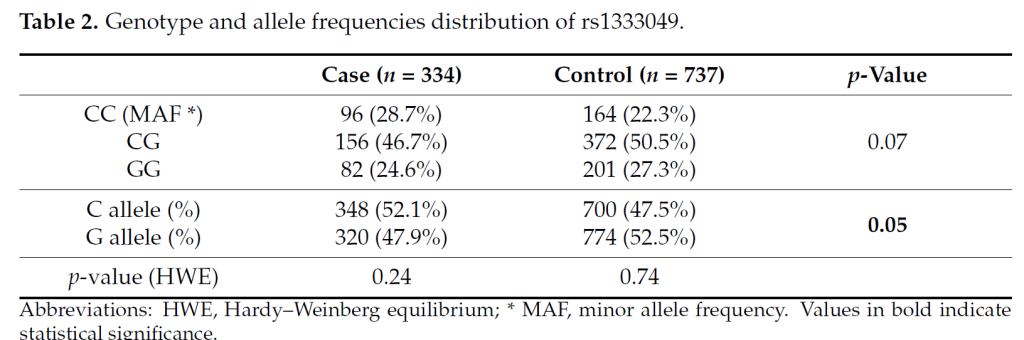
Bayan Aljabali等 [4] 在2024年研究了T2DM 患者磺脲类(SU)药物反应与 CDKN2B-AS1 多态性,结果发现:rs1333049 CC 基因型患者的 SU 诱导低血糖风险显著升高(OR=1.89,P=0.007),且糖化血红蛋白(HbA1c)下降幅度更小(P=0.003);机制解释:CC 基因型与 CDKN2B 低表达相关,导致胰岛 β 细胞增殖能力下降,胰岛素分泌储备不足,增加 SU 相关低血糖风险。该研究揭示 CDKN2A/B-AS1 在 T2DM 药物反应中的作用,为 SU 类药物的精准使用提供遗传指导。
2.2 动脉粥样硬化:ANRIL 介导的血管平滑肌细胞调控
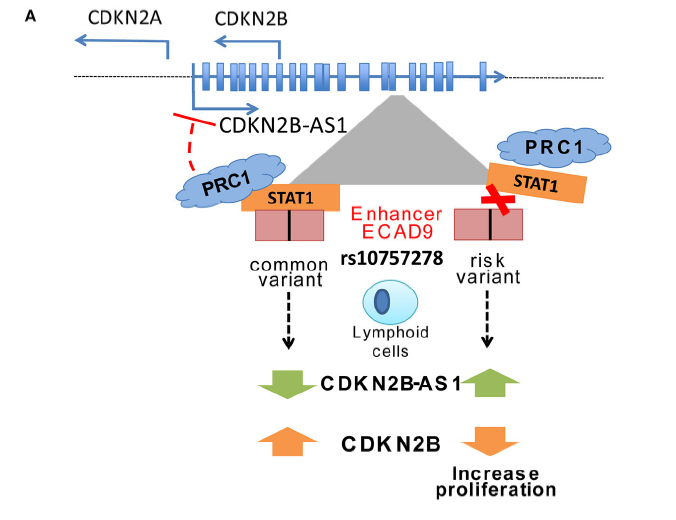
9p21.3 区域是动脉粥样硬化的经典风险区域,其作用主要通过 CDKN2B-AS1(ANRIL)调控 CDKN2A/B 实现。
Ada Congrains 等 [13] 对 57 名老年志愿者的研究显示,动脉粥样硬化相关表型的风险等位基因与 ANRIL(外显子 1-2)表达降低显著相关,且颈总动脉狭窄患者的 ANRIL 表达显著更低(P<0.01);体外实验证实,血管平滑肌细胞(VSMC)中 ANRIL 敲低可导致 CDKN2A/B 表达显著变化(P<0.05)及细胞生长抑制(P<0.05)[13]。这提示 ANRIL 通过调控 CDKN2A/B 影响 VSMC 增殖,进而参与动脉粥样硬化发生,为疾病机制提供了分子解释。
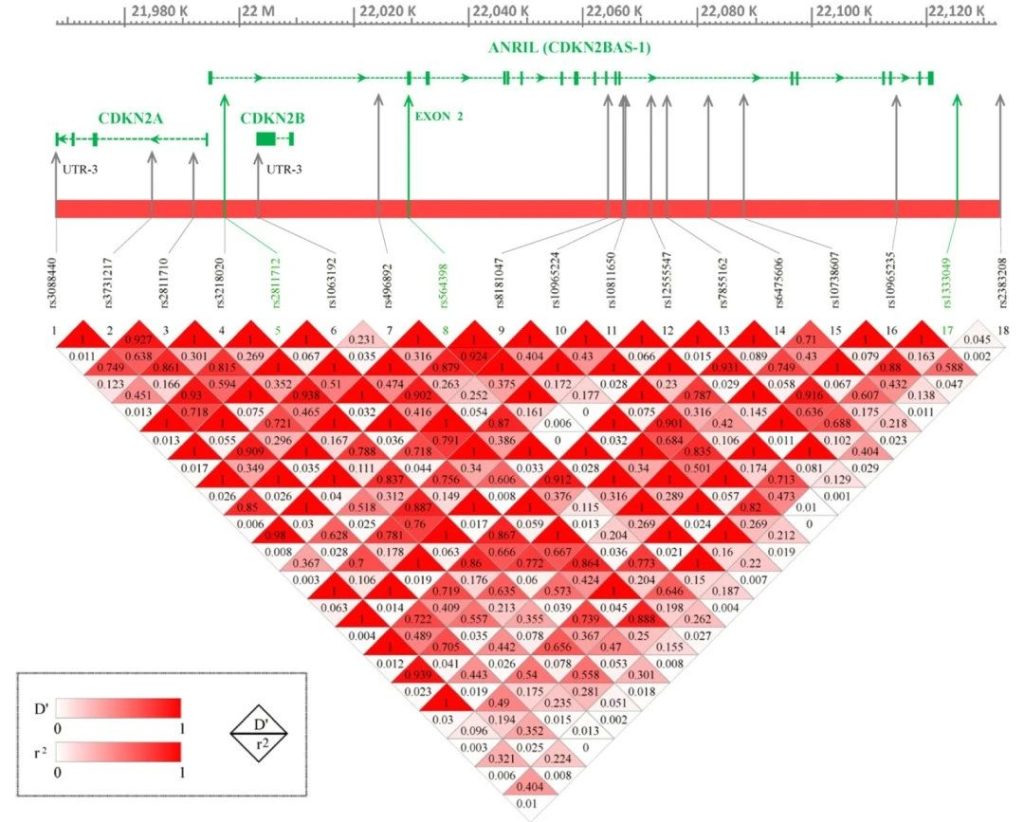
Fig. Linkage disequilibrium(LD) and transcriptional map of the 9p21 Iocus.
E. Pasmant 等 [14] 进一步证实,ANRIL 是 GWAS 中多个心血管疾病(冠心病、颅内动脉瘤、T2DM)的共享风险位点,且通过顺式作用机制调控 CDKN2A/B 表达,影响细胞增殖与衰老 [14]。Ada Congrains 等 [15] 的综述指出,ANRIL 通过表观遗传机制调控 CDKN2A/B,其异常表达与血管衰老、动脉粥样硬化密切相关,是心血管疾病的潜在治疗靶点 [15]。
2.3 早发性心血管病:单基因与多基因风险叠加
早发性心血管病(CVD)的遗传易感性涉及 CDKN2A/B 的单基因与多基因作用。
Muhammad M Meer 等 [29] 的综述指出,CDKN2A/B 作为细胞周期调控的核心基因,其突变可通过影响脂质代谢、血管完整性参与早发性 CVD;同时,多基因风险评分(PRS)显示,多基因的变异累积效应可显著提升早发性 CVD 的风险预测能力 [29]。此外,文章还提出:表观遗传修饰(如甲基化)与基因 – 环境交互作用(如饮食、运动)也可能通过影响基因表达,参与早发性 CVD 的发病 [29],为疾病预防提供了多维度视角。
2.4 非阻塞性冠状动脉心肌梗死(MINOCA):新型遗传诊断标志物
P. Severino等 [21] 揭示了揭示 CDKN2A/B-AS1 在非阻塞性心梗中的作用:患者的 CDKN2B-AS1 变异特征:rs4977756 GG 基因型患者的冠状动脉微血管阻力指数(CMR)显著升高(P=0.003),且与心肌灌注缺损发生率正相关(r=0.41,P=0.001);其功能验证发现体外微血管内皮细胞中,敲低 CDKN2B-AS1 可上调 CDKN2B 表达,抑制内皮型一氧化氮合酶(eNOS)活性,减少 NO 生成,导致微血管舒张功能障碍。
2.5 遗传交互与机制
V. Vazgiourakis等 [22] 在2023年首次将 CDKN2A/B-AS1 与 “妇科疾病 – 心血管疾病” 共病关联,拓展其在女性健康领域的研究维度。研究提出:子宫内膜异位症(EMS)与心血管疾病(CVD)共享遗传背景:9p21.3 区域(含 CDKN2A/B-AS1)是两者的共同风险位点,EMS 患者中 CDKN2B-AS1 rs1333049 C 等位基因频率显著高于健康女性(OR=1.32,P=0.008);其机制关联为:CDKN2B-AS1 通过调控 CDKN2B 表达,同时影响子宫内膜细胞增殖(EMS 病理)与血管平滑肌细胞衰老(CVD 病理),解释 EMS 患者 CVD 风险升高 2 倍的分子原因。
Tab. Overview of genetic polymorphisms in non-coding RNAs related to the development of both endometriosis and CVD.
C. Toader 等 [18] 在 2023 年的综述中指出,颅内动脉瘤(IA)作为心血管疾病的重要亚型,其遗传易感性与 9p21.3 区域(含 CDKN2A/B-AS1)密切相关 ——GWAS 显示,该区域变异与 IA 风险显著相关(OR=1.23,P=1.5×10−12),且这种关联与 ANRIL 调控 CDKN2A/B 表达、影响血管壁细胞(平滑肌细胞、内皮细胞)衰老相关 [18]。
此外,该综述还发现,IA 与冠心病共享多个遗传位点(如 9p21.3、1q25.3),提示两者可能存在共同的病理机制(如血管炎症、细胞外基质重塑)[18]。值得注意的是,CDKN2A/B 表达异常可通过增加血管壁细胞凋亡、促进钙化,间接参与 IA 的形成与破裂,为 IA 的遗传诊断与干预提供了新方向 [18]。
三
CDKN2A/B 在衰老与衰老相关疾病中的作用
CDKN2A(尤其是其编码的 p16INK4a)是细胞衰老的经典标志物,其表达随年龄升高,且与多种衰老相关疾病(如神经退行性疾病、慢性肾病、糖尿病相关衰老)的病理机制密切相关。
Bora Uyar 等 [38] 在 2020 年的研究中,通过单细胞转录组分析发现,衰老过程中 CDKN2A(p16INK4a)的表达变化具有双重特征:一方面,表达 p16 的细胞比例随年龄显著升高(如老年小鼠脂肪组织中 p16 + 细胞占比达 15%,vs 青年小鼠 2%);另一方面,p16 的平均表达水平在单细胞层面存在显著异质性 —— 这种异质性在老年个体中更为明显,可能与细胞类型(如免疫细胞、实质细胞)及微环境(如炎症程度)相关 [38]。此外,该研究还发现,衰老相关炎症(inflammaging)的驱动具有细胞特异性:在老年小鼠脾脏中,巨噬细胞的炎症基因(如 TNF-α、IL-6)表达升高与 p16 表达呈正相关,而 T 细胞的炎症反应则与 p16 无直接关联 [38]。更重要的是,该研究证实,单细胞水平的 p16 表达模式在不同研究中具有稳定性,可作为衰老研究的可靠指标,为后续 CDKN2A 相关衰老机制研究提供了技术参考 [38]。
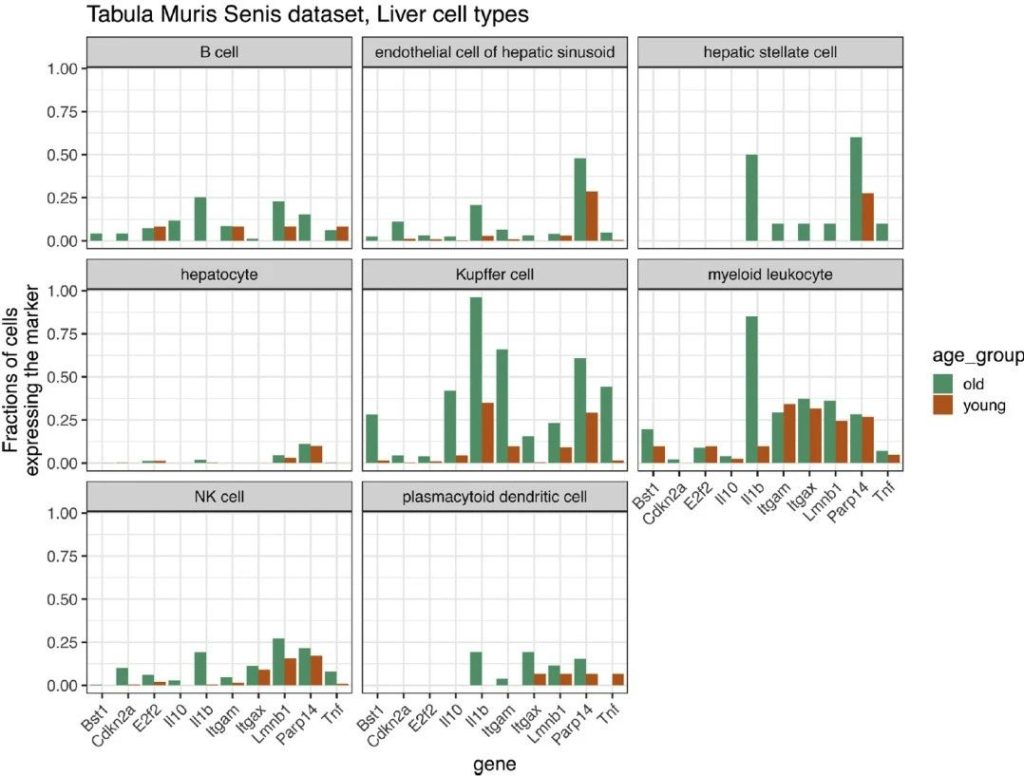
Fig. Faction of cesepesing 10 aging-related marker genes in liver cells of the Tabula Muris Senis.
Paula K. Bautista-Niño 等 [36] 在 2016 年的综述中提出,DNA 损伤(包括端粒 DNA 损伤、非端粒核 DNA 损伤及线粒体 DNA 损伤)是血管衰老的核心驱动因子,而 CDKN2A(p16INK4a)是 DNA 损伤诱导衰老的关键效应分子 [36]。具体而言,随年龄增长,血管细胞(内皮细胞、VSMC)的 DNA 修复能力下降,未修复的 DNA 损伤可激活 p53-p21 通路,进而上调 CDKN2A 表达,导致细胞周期停滞与衰老 [36]。该综述还指出,在 CKD、糖尿病等疾病中,氧化应激、尿毒症毒素等因素可加速 DNA 损伤积累,通过 “DNA 损伤 – CDKN2A 激活 – 血管衰老” 轴加剧血管功能障碍 [36]。此外,该研究提出了潜在的干预策略:如激活 AMPK-mTOR-NFκB 轴抑制 DNA 损伤反应、补充维生素 E 减少氧化应激诱导的 DNA 损伤,这些策略可能通过下调 CDKN2A 表达延缓血管衰老 [36]。
Loren Kell 等 [28] 在 2023 年的综述中指出,CDKN2A 介导的细胞衰老不仅影响实质器官,还在免疫衰老(immunosenescence)中发挥关键作用 ——DNA 损伤可通过激活 CDKN2A(p16INK4a),导致免疫细胞(尤其是 T 细胞)增殖能力下降、细胞毒性功能减弱 [28]。具体机制包括:T 细胞活化过程中,抗原受体信号诱导的 DNA 损伤若未被有效修复,可上调 p16 表达,导致 T 细胞停滞于 G1 期,无法分化为效应 T 细胞;此外,CDKN2A 还可通过抑制 NFκB 通路,减少 T 细胞分泌 IFN-γ、TNF-α 等细胞因子,削弱免疫监视功能 [28]。该综述还提出,“基因保护”(genoprotection)策略(如补充 NAD + 前体促进 DNA 修复、使用抗氧化剂减少氧化应激)可通过降低 CDKN2A 表达,改善老年个体的免疫功能 [28]。值得注意的是,该综述强调,CDKN2A 在免疫细胞中的表达变化可作为免疫衰老的生物标志物,为评估老年个体感染风险(如流感、COVID-19)提供参考 [28]。
3.1 生物衰老标志物:从动物模型到人类疾病
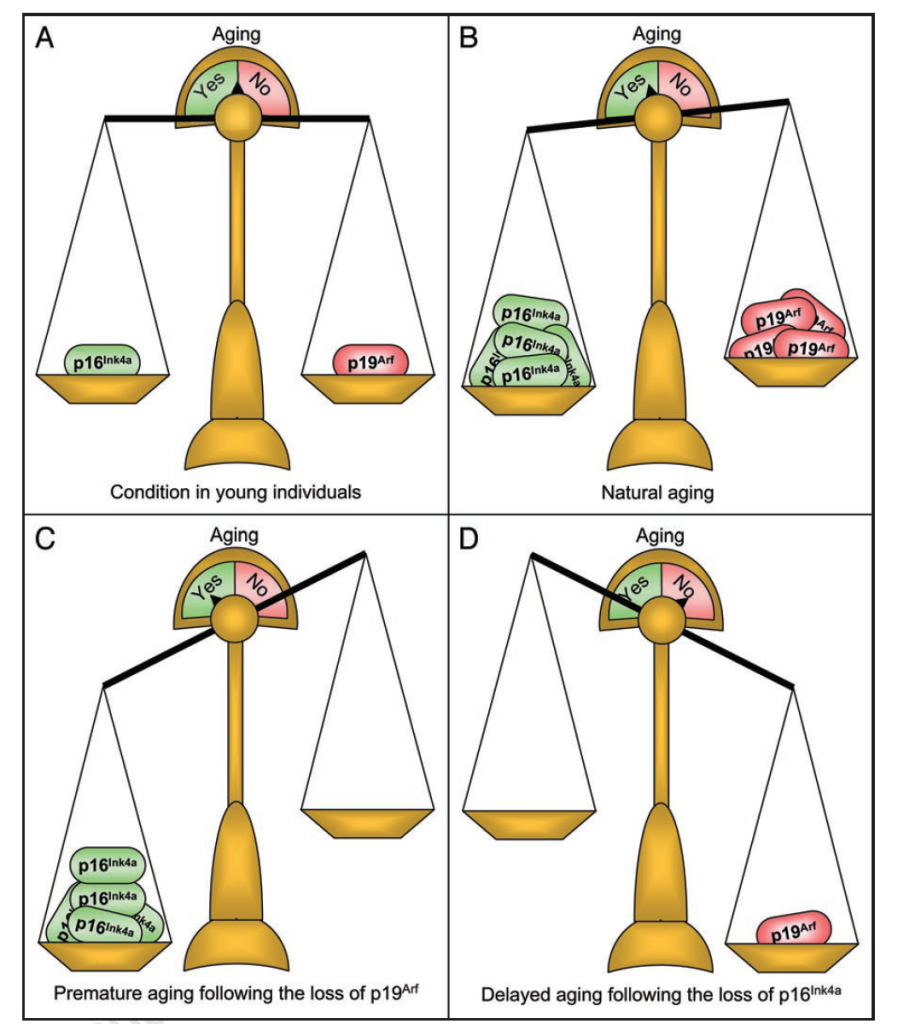
在动物模型中,Darren J. Baker 等 [37] 对 BubR1 低表达小鼠(早衰模型)的研究显示,骨骼肌和脂肪组织中 p16Ink4a(CDKN2A 编码)表达升高,且敲除 p16Ink4a 可延迟这些组织的衰老与功能衰退;而敲除 p19Arf(CDKN2A 另一编码产物)则加剧衰老 [37],表明 CDKN2A 的不同转录产物在衰老中具有相反作用。进一步研究 [41] 发现,清除 p16Ink4a 阳性细胞可延长小鼠中位寿命,延缓肾脏、心脏、脂肪组织的年龄相关损伤,证实 p16Ink4a 阳性细胞是衰老的关键效应因子 [41]。
Jonathan Plessis-Belair 等 [32] 的研究显示,CDKN2A(p16INK4a/Arf)表达随年龄显著升高,且热量限制可降低肾脏、卵巢、心脏中 CDKN2A 的表达,同时减少衰老标志物与器官病理损伤 [32]。
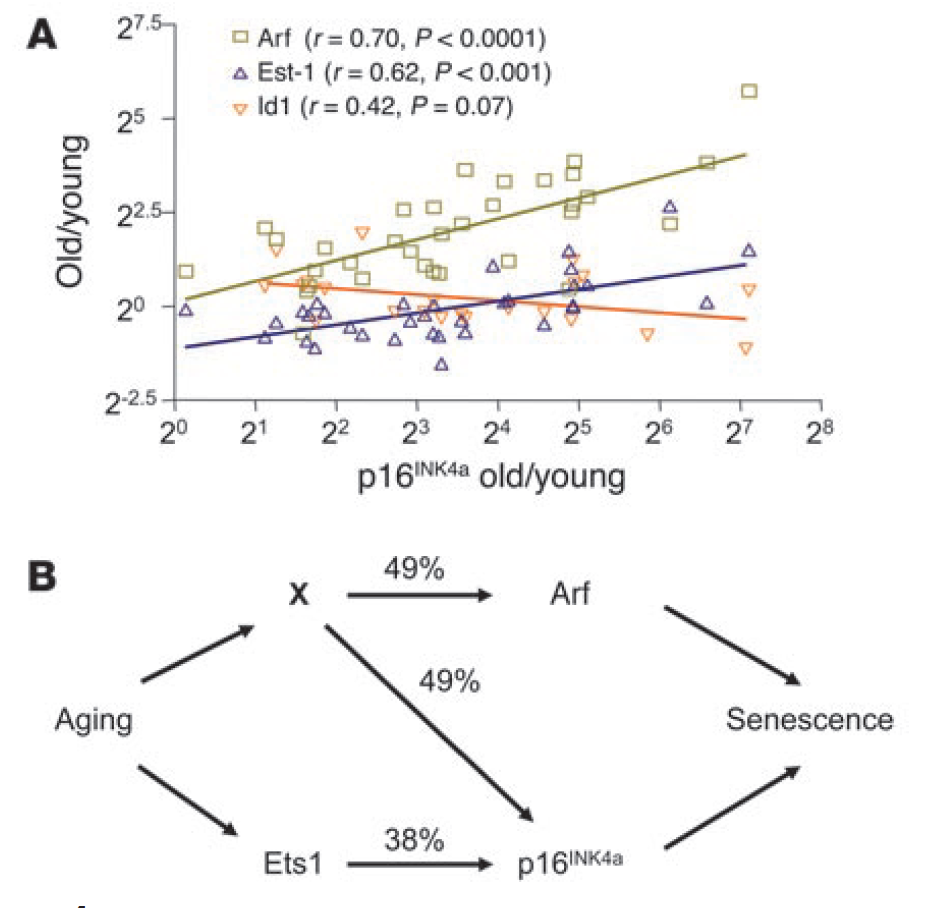
Fig. p16INK4a expression with aging strongly correlates with Arf and Ets-1 expression.
Joyita Banerjee 等 [33] 对印度中年人群(31-50 岁)的研究发现,T2DM 患者的血清 CDKN2A 水平显著高于健康对照,且与 IL-6、TNF-α 等炎症因子强相关;31-40 岁 T2DM 患者高 CDKN2A 风险 OR=3.484(P=0.017),41-50 岁患者 OR=5.000(P=0.001)[33],表明 T2DM 可加速 CDKN2A 介导的生物衰老,增加年龄相关并发症风险。
3.2 神经退行性疾病:诊断与鉴别标志物
神经退行性疾病(NND)中,Jonathan Plessis-Belair等[17] 揭示 CDKN2A 在 NDD 细胞周期失调中的关键作用,为靶向核输入通路的 NDD 治疗提供理论基础。研究结果显示,NDD中的 CDKN2A 激活机制:核输入缺陷(如 importin-β 抑制)可诱导神经元从 G0 期重新进入细胞周期,最终停滞于 G1/S 期,此过程伴随 CDKN2A(p16INK4a)显著上调(P<0.001);经动物模型验证,NemfR86S 运动神经元病小鼠模型中,脊髓运动神经元的 CDKN2A 表达升高 3.2 倍,且与神经元死亡数量正相关(r=0.52,P=0.003)。
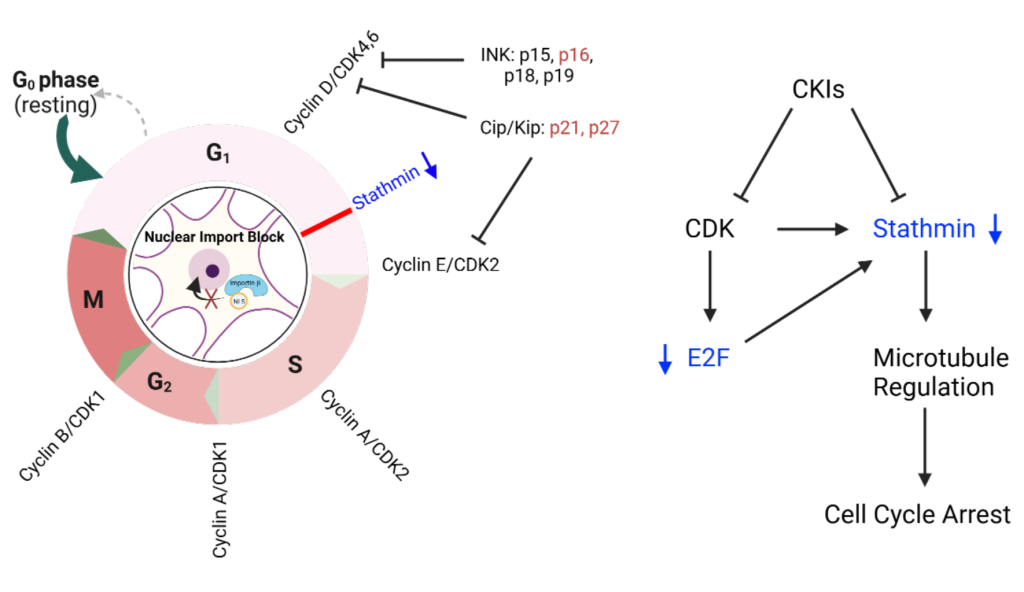
Fig. Graphical Abstract: Overview of Dysregulated Cell Cycle Mechanisms in Neuronal Cells.
在阿尔茨海默病(AD)中,Hiroaki Mori 等 [34] 对 46 例 AD 患者、55 名健康对照的研究显示,血液 CDKN2A mRNA 表达与年龄呈正相关(r=0.407,P=0.005),但 AD 患者的 CDKN2A 表达显著低于健康对照;且仅 AD 患者中 CDKN2A 表达与基因甲基化率呈正相关 [34],提示血液 CDKN2A 表达可作为 AD 与正常衰老、其他神经退行性疾病(如帕金森病)的鉴别标志物。
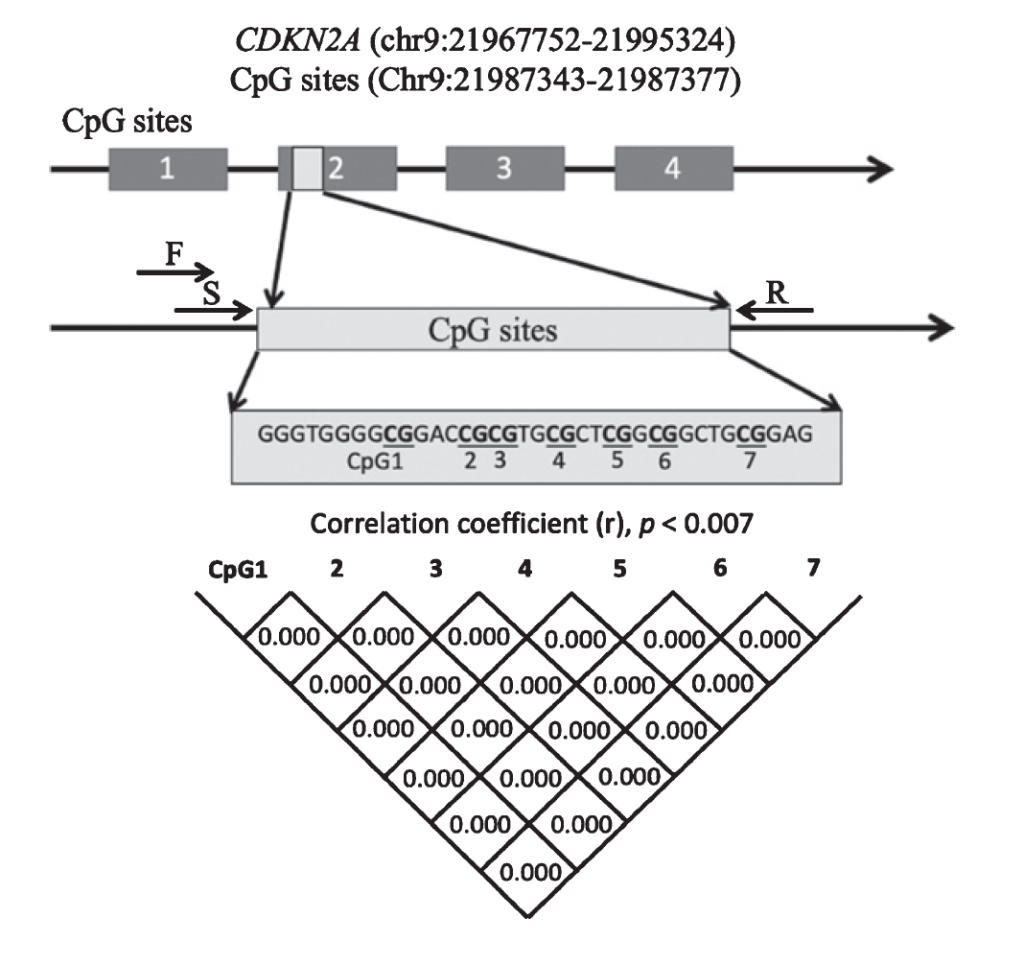
Fig. Schematic diagram showing the location of the CDKN2A exon 2 region that was analyzed.
在帕金森病(PD)中,Estel Ramos-Marquès 等 [20] 对 132 例人类左心室样本的分析显示,CDKN2A 表达是生物年龄(BA)的关键标志物,其预测衰老相关转录组变化的能力优于实际年龄(CA);且 CDKN2A 高表达与心脏纤维化(PD 相关心脏损伤)显著相关 [20],提示 CDKN2A 可能通过调控心肌细胞衰老,参与 PD 的多系统病理损伤。
在精神分裂症(SCZ)中,Takumi Nakamura等[26] 首次将 CDKN2A 与精神分裂症关联,为神经精神疾病的细胞周期调控机制提供新视角。研究发现,SCZ患者的 CDKN2A 表达异常:死后前额叶皮层样本中,CDKN2A mRNA 水平显著高于健康对照(P=0.002),且与神经元密度降低呈负相关(r=-0.38,P=0.005);其遗传关联结果表明,GWAS 荟萃分析显示,CDKN2A rs10811661 T 等位基因与 SCZ 风险相关(OR=1.08,P=2.3×10−6),且该等位基因与 CDKN2A 高表达显著关联(eQTL 分析,P=4.7×10−4)。
3.3 慢性肾病:血管早衰的驱动因子
慢性肾病(CKD)患者常表现出血管早衰表型,CDKN2A 是其关键调控因子。
Peter Stenvinkel 等 [35] 对 61 例 CKD 肾移植患者的动脉活检显示,尿毒症环境中 CDKN2A(p16INK4a)表达升高与血管早衰独立相关(校正年龄后 P<0.001),且 CDKN2A 高表达患者的冠状动脉钙化(P=0.01)、心血管病(P=0.004)发生率显著更高;机制上,CDKN2A 表达与维生素 K 介导的羧化功能负相关,提示维生素 K 缺乏可能通过 CDKN2A 加剧血管衰老 [35]。
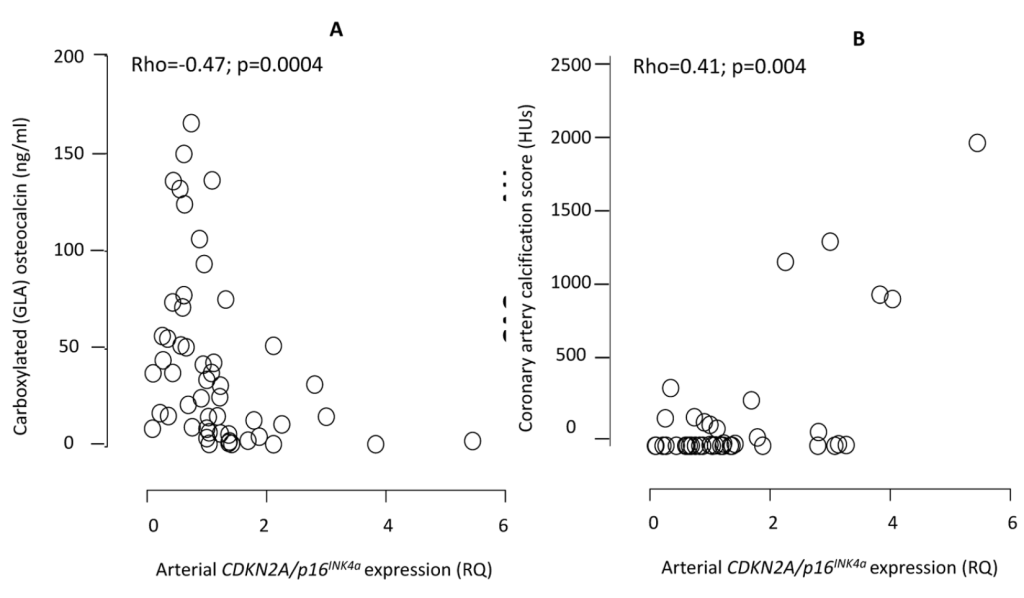
Fig. Correlations between the arterial expression of CDKN2A/p16INK4a and circulating levels of carboxylated (GLA) active osteocalcin (A) and coronary artery calcification by CT heart (B).
在终末期肾病(ESRD)中,Keiichi Sumida 等 [40] 对 34 例血液透析患者的研究显示,核因子 Nrf2(抗氧化关键因子)表达与 CDKN2A 表达呈显著负相关(rho=-0.51,P=0.002),且该关联独立于年龄、性别、糖尿病状态(β=-1.51,P=0.01)[40],表明 Nrf2 功能障碍可能通过上调 CDKN2A,促进 ESRD 患者的生物早衰,为疾病干预提供了新靶点。
3.4 端粒长度相关:潜在标志物
José Alberto López-Domínguez等[30] 在小鼠模型中发现CDKN1A变体 2(而非变体 1)在老年小鼠的肝脏、肾脏、心脏中选择性上调(P<0.001);并发现,在健康老年人(70-89 岁)的外周血中,CDKN1A变体 2水平显著高于中青年(20-40 岁),且与端粒长度负相关(r=-0.39,P=0.004)。
3.5 肠道功能减弱
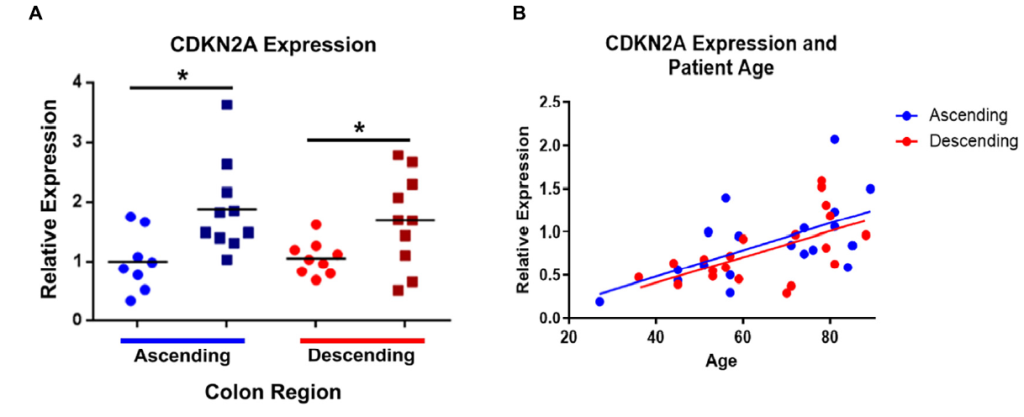
Alexandra Palmer 等 [42] 在 2021 年的研究中,首次探索了 CDKN2A(p16)在老年结肠肌间神经元中的表达变化及其与肠道功能的关联。该研究对 52 例成人(27-89 岁)的结肠样本分析发现,CDKN2A 表达随年龄升高显著上调,且这种上调具有区域依赖性:升结肠肌间神经元的 p16 阳性率(老年组 18.2% vs 青年组 3.5%,P<0.01)显著高于降结肠(老年组 5.1% vs 青年组 2.8%,P>0.05)[42]。进一步免疫共定位实验显示,p16 主要定位于肌间神经细胞体的细胞质(而非细胞核),且与神经元标志物 MAP2 共表达,提示其可能参与有丝分裂后神经元的衰老样功能改变 [42]。此外,该研究还发现,升结肠 p16 高表达的老年患者,其排便频率异常(便秘或腹泻)的发生率显著升高(OR=2.97,P=0.03),表明 CDKN2A 表达异常可能通过影响肠神经功能,参与老年肠道功能衰退 [42]。
四
长寿:遗传交互作用与功能能力调控
CDKN2B 的多态性通过与其他长寿相关基因的交互作用,影响人类晚年生存与功能能力。
Maja Šetinc 等 [2] 对 327 名克罗地亚 85 岁以上人群的研究显示,尽管无单个 SNP 独立影响生存,但 14 对 SNP 交互作用达到名义显著水平(P<0.05),其中 CDKN2B 的 rs1333049 与 FOXO3(长寿关键基因)的多个 SNP、LINC02227 的 rs2149954 存在交互作用,且这些交互作用在调整健康相关变量后仍显著 [2]。这表明 CDKN2B 通过遗传网络协同调控晚年生存,而非单一基因效应。
在功能能力方面,Maja Šetinc 等 [6] 对 314 名克罗地亚 85 岁以上老年人的研究发现,CDKN2B 的 rs4977756 是功能能力评分的独立显著预测因子(纳入解释 37.1% 方差的最佳模型),与 TERC 的 rs16847897、MRE11A 的 rs533984 及慢性病数量、简易精神状态评分共同影响老年人的活动能力 [6]。此外,rs16847897 的 GG 纯合子(与长寿相关)与老年人自评健康、移动能力、独立性均显著相关,提示 CDKN2B 所在的 DNA 损伤修复通路通过调控细胞衰老,直接影响老年人的整体活力 [6],为长寿机制研究提供了分子线索。
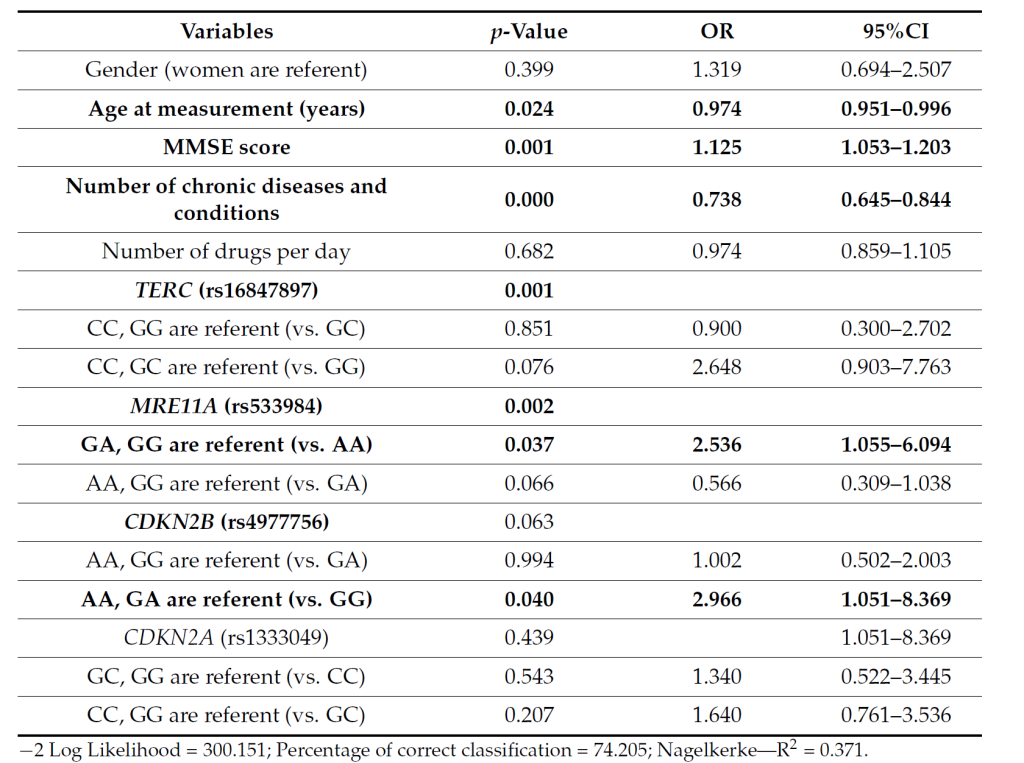
Tab. The multivariate logistic regression model for the dichotomised value of the sum of selfperceived mobility and independence in the Croatian oldest-old sample (N = 314).
五
CDKN2A/B 在其他疾病中的作用
除上述疾病外,CDKN2A/B 还与原发性开角型青光眼、长寿相关,进一步体现其功能的多样性。
5.1 原发性开角型青光眼:小梁网细胞衰老调控
原发性开角型青光眼(POAG)是常见致盲眼病,CDKN2A/B-AS1 轴在其发病中发挥关键作用。原发性开角型青光眼(POAG)是全球致盲率最高的眼病之一,其核心病理特征是小梁网(TM)细胞功能异常导致的眼内压升高,而 CDKN2B-AS1-CDKN2B 轴是调控该过程的关键分子通路。
Sonika Rathi 等 [31] 对 1567 例非洲裔美国 POAG 患者和 1600 名对照的研究显示,CDKN2B-AS1 的 rs4977756 多态性与 POAG 及其内表型显著相关:该位点与垂直杯盘比(P=0.033)、中央角膜厚度(P=0.008)直接关联,且荧光素酶报告实验证实 rs4977756 周围区域具有转录抑制功能 [31]。进一步体外实验表明,在 HEK293T 细胞和小梁网细胞中敲低 CDKN2B-AS1,可导致 CDKN2B 表达显著升高,且这种表达变化在人类 POAG 眼组织中同样存在;同时,CDKN2B-AS1 抑制会引发小梁网细胞的细胞衰老、TGFβ 信号激活及细胞外基质沉积增加 [31],提示 CDKN2B-AS1 通过下调 CDKN2B 抑制小梁网细胞衰老,其功能异常可能通过 CDKN2B 过表达加速 POAG 病理进程。
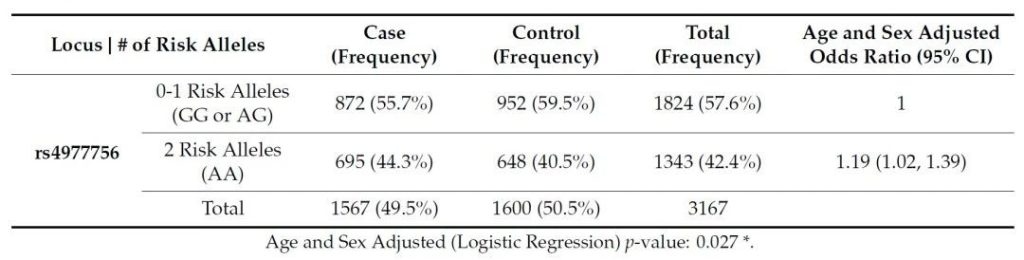
Tab. Asociaton betveenrs497756 genotypesand POAC disease status(casev5.contro) accoding toa recsivemodel of POAG risk Analyses controled forageand sex”denotesa significant result for x= 0.05.
此外,Wioletta Rozpędek-Kamińska 等 [8] 的综述指出,POAG 的遗传易感性与 9p21.3 区域密切相关,CDKN2A/B 的甲基化异常可能通过影响小梁网细胞周期稳态,参与眼内压调控 [8],进一步支持 CDKN2A/B 家族在 POAG 中的核心作用。
5.2 慢性丙型肝炎(C-HC):肝炎相关肝衰老的干预靶点
Mark W. Robinson等 [39] 在2013年首次报道 CDKN2A 的非细胞自主性激活在慢性肝病中的作用。研究发现,C-HC患者的 CDKN2A 异常:外周血单核细胞中,CDKN2A mRNA 水平显著高于健康对照(P=0.001),且与肝纤维化分期正相关(r=0.45,P=0.002);其异常机理为非细胞自主性机制,即C-HC 患者血清中的 IL-6、TNF-α 可诱导肝细胞外 CDKN2A 表达,通过旁分泌效应加速肝脏衰老,此过程可被抗 IL-6 抗体阻断(P=0.003)
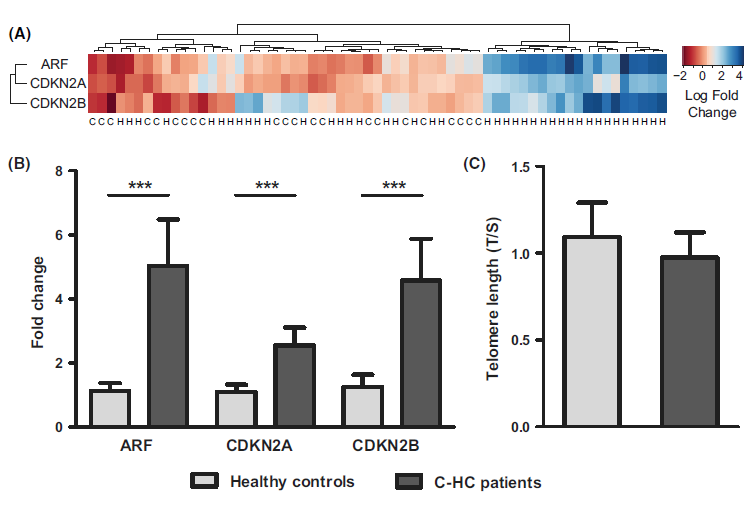
Fig. Expression of CDKN2 locus transcripts and relative telomere length in patients with C-HC and healthy controls
5.3 先天性糖基化障碍(CDG):遗传代谢异常标志物
R. Francisco等 [27] 2023年首次将 CDKN2A 表观遗传异常与罕见病 CDG 关联。研究发现,CDG中的 CDKN2A 甲基化异常:CDG-Ia 型患者的外周血淋巴细胞中,CDKN2A 启动子甲基化率显著升高(P=0.001),且与患者发育迟缓评分正相关(r=0.42,P=0.003);机制推测:糖基化缺陷导致 CDKN2A 甲基化酶(如 DNMT1)活性异常,进而抑制 CDKN2A 表达,加速细胞衰老,加重 CDG 的发育障碍。
六
总结与展望
CDKN2A/B 基因簇(含 CDKN2A、CDKN2B 及 CDKN2B-AS1/ANRIL)是横跨肿瘤、心血管疾病、神经退行性疾病、衰老及眼科疾病的关键分子节点,其作用具有以下核心特征:
1.疾病机制的多样性
在肿瘤中,CDKN2A/B 多通过纯合缺失、甲基化或多态性导致抑癌功能丧失,且存在情境依赖性(如 BE 中抑制癌变、EAC 中促进进展 [23]);在心血管疾病中,CDKN2B-AS1 通过调控 CDKN2A/B 影响血管平滑肌细胞增殖与动脉粥样硬化 [13,15];在衰老相关疾病中,CDKN2A(p16INK4a)作为生物衰老标志物,通过细胞周期停滞参与神经退行性疾病、慢性肾病的病理进程 [34,35]。
2.临床应用的实用性
CDKN2A/B 已成为多个疾病的诊断、预后及治疗预测标志物 —— 在脑胶质瘤中,CDKN2A/B 缺失是 WHO 4 级分型的标准 [25];在食管癌中,CDKN2A 甲基化可作为早期诊断生物标志物(特异性 96%[16]);在尿路上皮癌中,CDKN2A/B 突变预测恩诺单抗 – 维汀耐药 [24];在肝内胆管癌中,CDKN2A/B 缺失提示帕博西尼治疗获益 [12]。
3.研究方向的前瞻性
现有研究仍存在未解决的关键问题,如 CDKN2A/B 在不同疾病中的组织特异性调控机制、非编码 RNA(如 CDKN2B-AS1)的表观遗传调控网络、基因 – 环境交互作用(如饮食对 CDKN2A 甲基化的影响)等。
未来需通过单细胞多组学、类器官模型及大规模前瞻性队列,进一步解析 CDKN2A/B 的功能网络,推动其在精准诊断与靶向治疗中的转化应用。
综上,CDKN2A/B 基因簇的研究不仅深化了对多疾病病理机制的理解,更为跨疾病的分子诊疗提供了统一的靶点框架,具有重要的基础研究与临床实践价值。
参考文献:
[1]. Zheng Ye, et al. SNP rs615552 and lncRNA CDKN2B-AS1 influence brain cancer pathogenesis through multi-omic mechanisms.Scientific Reports 2025
[2]. Maja Šetinc, et al. The role of longevity-related genetic variant interactions as predictors of survival after 85 years of age. Mechanisms of Ageing and Development 2024
[3]. Maryam Aghasipour, et al. A comprehensive consolidation of data on the connection between CDKN2A polymorphisms and the susceptibility to childhood acute lymphoblastic leukemia. Hematology, Transfusion and Cell Therapy 2024
[4]. Bayan Aljabali. An Overview of the Pharmacogenetics of Sulfonylurea in Type 2 Diabetes Mellitus. Journal of Advanced Pharmacy Research 2024
[5]. J. Foss-Skiftesvik, et al. Multi-ancestry genome-wide association study of 4069 children with glioma identifies 9p21.3 risk locus. Neuro-Oncology 2023
[6]. Maja Setinc, et al. Genes Involved in DNA Damage Cell Pathways and Health of the Oldest-Old (85+). Genes 2023
[7]. Miha Tibaut, F. Naji, D. Petrovič. Association of Myocardial Infarction with CDKN2B Antisense RNA 1 (CDKN2B-AS1) rs1333049 Polymorphism in Slovenian Subjects with Type 2. Diabetes Mellitus. Genes 2022
[8]. Wioletta Rozpędek-Kamińska, et al. The Genetic and Endoplasmic Reticulum-Mediated Molecular Mechanisms of Primary Open-Angle Glaucoma. International Journal of Molecular Sciences 2020
[9]. Beska Z Witka, et al. Type 2 Diabetes-Associated Genetic Polymorphisms as Potential Disease Predictors. Diabetes, Metabolic Syndrome and Obesity : Targets and Therapy 2019
[10]. H. Giral, et al. Into the Wild: GWAS Exploration of Non-coding RNAs. Frontiers in Cardiovascular Medicine 2018
[11]. E. Hungate, et al. A variant at 9p21.3 functionally implicates CDKN2B in paediatric B-cell precursor acute lymphoblastic leukaemia aetiology. Nature Communications 2016
[12]. Liu K, Huang Z, Zhao L, Zhao H. Significant Response to Palbociclib Plus Lenvatinib as Second-line Treatment for CDKN2A/2B Deletion Intrahepatic Cholangiocarcinoma: A Case Report. J Clin Transl Hepatol. 2025
[13]. Ada Congrains, et al. Genetic variants at the 9p21 locus contribute to atherosclerosis through modulation of ANRIL and CDKN2A/B. Atherosclerosis 2012
[14]. E. Pasmant, et al. ANRIL, a long, noncoding RNA, is an unexpected major hotspot in GWAS. The FASEB Journal 2011
[15]. Ada Congrains, et al. ANRIL: Molecular Mechanisms and Implications in Human Health. International Journal of Molecular Sciences 2013
[16]. Chongchang Zhou, Jinyun Li, Qun Li. CDKN2A methylation in esophageal cancer: a meta-analysis. OncoTarget 2017
[17]. Jonathan Plessis-Belair, et al. Nuclear Import Defects Drive Cell Cycle Dysregulation in Neurodegeneration. bioRxiv 2025
[18]. C. Toader, et al. Intracranial Aneurysms and Genetics: An Extensive Overview of Genomic Variations, Underlying Molecular Dynamics, Inflammatory Indicators, and Forward-Looking. Insights. Brain Science 2023
[19]. Role of Cancer Gene in Esophageal Adenocarcinoma May Support Paradigm Shift in Predicting Disease. By The ASCO Post Staff, 2025
[20]. Estel Ramos-Marquès, et al. Chronological and biological aging of the human left ventricular myocardium: Analysis of microRNAs contribution. Aging Cell 2021
[21]. P. Severino, et al. Myocardial Infarction with Non-Obstructive Coronary Arteries (MINOCA): Focus on Coronary Microvascular Dysfunction and Genetic Susceptibility. Journal of Clinical Medicine 2023
[22]. V. Vazgiourakis, et al. Association of endometriosis with cardiovascular disease: Genetic aspects (Review). International Journal of Molecular Medicine 2023
[23]. Piyali Ganguli, et al. Context-dependent effects ofCDKN2Aand other 9p21 gene losses during the evolution of esophageal cancer[J].Nature Cancer, 2025
[24]. T. Jindal, C. Jiang, O. Alhalabi et al., Genomic Biomarkers Associated with Enfortumab Vedotin Outcomes for Patients with Advanced Urothelial Carcinoma: Analysis of UNITE Study Data. Eur Urol Oncol.2025
[25]. Wetzel EA, et al. A multi-center, clinical analysis of IDH-mutant gliomas, WHO Grade 4: implications for prognosis and clinical trial design. J Neurooncol. 2025 Jan;171(2):373-381.
[26]. Takumi Nakamura, A. Takata. The molecular pathology of schizophrenia: an overview of existing knowledge and new directions for future research. Molecular Psychiatry 2023
[27]. R. Francisco, et al. Congenital disorders of glycosylation (CDG): state of the art in 2022. Orphanet Journal of Rare Diseases 2023
[28]. Loren Kell, et al. The central role of DNA damage in immunosenescence. Frontiers in Aging 2023
[29]. Muhammad M Meer, et al. Role of Genetics in Early-Onset Cardiovascular Disease. Cureus 2025
[30]. José Alberto López-Domínguez, et al. Cdkn1a transcript variant 2 is a marker of aging and cellular senescence. Aging 2021
[31]. Sonika Rathi , et al. Molecular Genetics and Functional Analysis Implicate CDKN2BAS1-CDKN2B Involvement in POAG Pathogenesis. Cells 2020
[32]. Janakiraman Krishnamurthy, et al. Ink4a/Arf expression is a biomarker of aging. Journal of Clinical Investigation 2004
[33]. Joyita Banerjee, et al. Middle-Aged Indians with Type 2 Diabetes Are at Higher Risk of Biological Ageing with Special Reference to Serum CDKN2A. Journal of Diabetes Research 2020
[34]. Hiroaki Mori, et al. Blood CDKN2A Gene Expression in Aging and Neurodegenerative Diseases. Journal of Alzheimer’s Disease 2021
[35]. Peter Stenvinkel, et al. CDKN2A/p16INK4a expression is associated with vascular progeria in chronic kidney disease. Aging 2017
[36]. Paula K. Bautista-Niño, et al. DNA Damage: A Main Determinant of Vascular Aging. International Journal of Molecular Sciences 2016
[37]. Darren J. Baker, et al. The yin and yang of the Cdkn2a locus in senescence and aging. Cell Cycle 2008
[38]. Bora Uyar, et al. Single-cell analyses of aging, inflammation and senescence. Ageing Research Reviews 2020
[39]. Mark W. Robinson, et al. Non cell autonomous upregulation of CDKN2 transcription linked to progression of chronic hepatitis C disease. Aging Cell 2013
[40]. Keiichi Sumida, et al. Association between Nrf2 and CDKN2A expression in patients with end-stage renal disease: a pilot study. Aging 2020
[41]. Darren J. Baker, et al. Naturally occurring p16Ink4a-positive cells shorten healthy lifespan. Nature 2016
[42]. Alexandra Palmer, et al. Expression of p16 Within Myenteric Neurons of the Aged Colon: A Potential Marker of Declining Function. Frontiers in Neuroscience 2021
推荐阅读
APOE介导的星形胶质细胞与神经元之间的细胞间脂质转运[4]
二
APOE 多态性与阿尔茨海默病
APOE ε4 携带者的认知衰退速率更快,尤其在记忆力、执行功能等流体认知领域表现显著[11,12,13]。
2024年发表的一篇文章研究探讨 APOE 是否与 SCD(主观认知衰退) 和轻度认知障碍(MCI)人群的认知变化速率相关。


