从基因变异到无限增殖:TERT在癌症中的重要作用
- boke
- 2025-12-05
- 10:05 上午
一
TERT基因概述
TERT 基因是编码端粒酶复合体的重要基因之一,全称为端粒酶逆转录酶(telomerase reverse tranase,TERT),人类TERT基因位于染色体5p15.33,包含16个外显子,15个内含子和一个包含330个碱基对的启动子核心区[1]。
TERT由1132个氨基酸组成,包含4个端粒酶特异性基序,包括促进端粒酶持续合成的C-端结构域(CTE)、与端粒酶活性密切相关的N-端结构域(TEN)、与RNA有结合位点的TRBD结构域、具有逆转录功能的RT结构域。
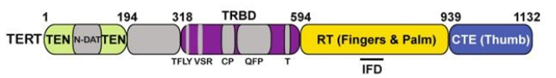
图1 TERT基因结构示意图
二
TERT基因生物学功能
正常细胞中,端粒酶活性通常被严格控制,在大多数组织中水平很低,仅在生殖细胞和造血干细胞等少数细胞中存在并受到高度调控。而对于肿瘤细胞,超过90%都表现出端粒酶过度表达,从而可以维持或延长端粒的长度,并导致细胞的恶性增殖及永生。
TERT主要生物学功能包括[2]:
(1)TERT参与维持端粒的长度和完整性
随着细胞分裂,由于DNA复制机制的限制,端粒会自然缩短。TERT作为端粒酶复合物的一部分,向染色体末端添加重复DNA序列(端粒重复序列),以维持端粒长度。
(2)维持免疫系统功能
TERT在某些免疫细胞群体(如T淋巴细胞和B淋巴细胞)中表达,在免疫反应过程中维持这些细胞的增殖能力,确保免疫细胞能够有效分裂和复制,这对于维持强大的免疫系统至关重要。
(3)参与胚胎发育和组织修复
TERT参与早期胚胎发育,促进分裂细胞中的端粒延长,这对胚胎的形成和生长至关重要。在胃肠道黏膜和皮肤等细胞更新率高的组织中,TERT能够持续补充受损或死亡的细胞,并且在修复和再生过程中端粒酶活性会被上调,这对组织修复和再生具有重要意义。
(4)TERT基因与细胞衰老相关
端粒的逐渐缩短和 TERT 活性的降低与细胞衰老相关。当端粒缩短超过临界值时,细胞会失去正常分裂和功能能力,导致细胞衰老与老化。在临床前模型中,通过一种小分子化合物(TAC)恢复TERT水平,可以降低细胞衰老和组织炎症,促进新神经元的形成,改善记忆,增强神经肌肉功能,从而增强力量和协调性[3]。
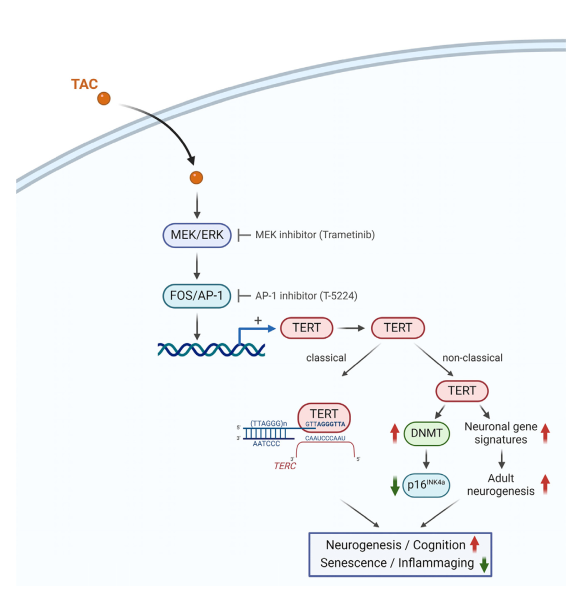
图2 TAC/TERT驱动的抗衰老作用的示意图
(5)TERT与肿瘤的发生和发展密切相关
恶性肿瘤的关键特征:TERT基因的异常激活,导致端粒酶活性增加,获得无限增殖潜能。
三
TERT基因活性调控
影响TERT基因异常表达的驱动因素有很多,包括转录调控、TERT 拷贝数变异、TERT启动子突变(TPM)、TERT高甲基化肿瘤区域(TERT hypermethylated oncological region,THOR)等。其中最主要的两种机制为TERT基因启动子区甲基化,占53%;TERT基因启动子区突变,占31%[4]。
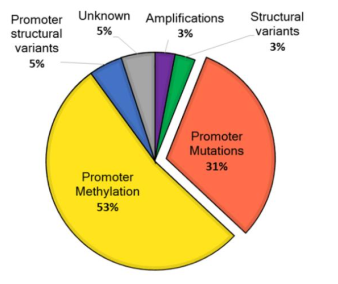
图3 TERT在癌症中重新激活的不同机制[4]
1
转录调控与表观遗传修饰
(1)转录调控
TERTp含有大量直接或间接调节基因表达的转录激活因子和抑制因子的结合位点。MYC、Sp1、ETS家族(如GABPA/B1)等转录因子通过结合TERT启动子区域激活转录。MYC是首个被发现的能激活端粒酶的细胞癌基因。在人类成纤维细胞或上皮细胞中异位表达c-MYC,能显著增加TERT表达和端粒酶活。

图4 多种关键分子参与增强和抑制TERT的转录[2]
(2)DNA甲基化
基因转录不仅涉及转录因子在启动子/增强子区域的组装,还包括对DNA可及性的调控,这一过程由表观遗传机制控制。DNA甲基化、组蛋白乙酰化磷酸化均已被证明参与TERT转录调控。在对儿童脑肿瘤的患者研究中发现了TERT高甲基化肿瘤区域(THOR),该区域的甲基化与TERT的表达增加相关。
2
基因组变异
(1)启动子突变
常见的 TERT 启动子突变发生在某些热点区域,如 c.-124C > T (C228T)和c.- 146C > T (C250T)。TERT启动子突变时都会产生新的ETS转录因子结合位点,此时ETS家族转录因子(GABPA及其辅助因子GABPB)与结合位点结合,从而促进TERT转录和端粒酶的激活,并促进肿瘤的发生发展[4]。
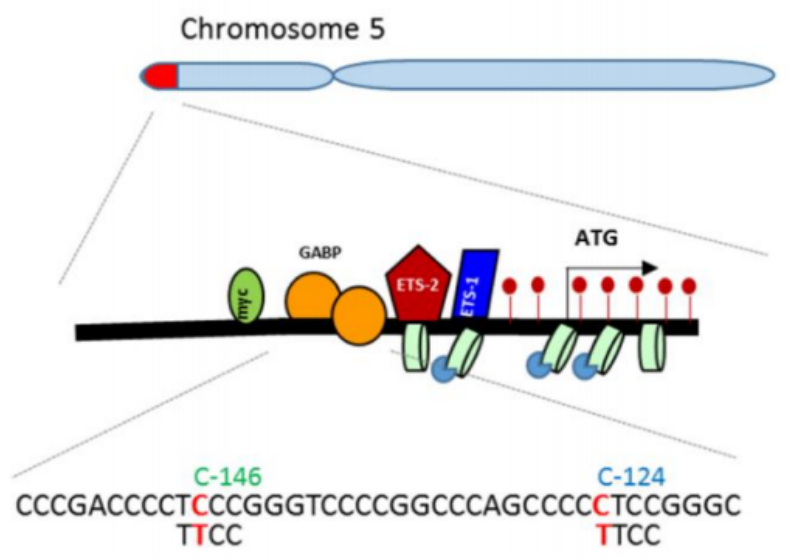
图5 启动子突变位点[4]
(2)TERT基因重排
绝大多数TERT重排会造成超增强子与相邻TERT编码序列的直接重叠。这种重叠通过增强子劫持机制发挥作用,从而实现TERT基因大规模染色质重塑与转录激活。
首次发现TERT基因座的重排现象是在永生人成纤维细胞中,并伴随TERT激活。通过多色荧光原位杂交技术分析套细胞淋巴瘤(MCL),发现4/8 MCL来源细胞系和1/23患者中存在TERT重排,且这些细胞系和患者细胞均显著高表达TERT基因。借助高通量测序技术,TERT重排在多种癌症类型中激活端粒酶中被发现,包括神经母细胞瘤、胶质母细胞瘤、脑膜瘤、恶性黑色素瘤、肝癌等。TCGA队列患者分析显示,TERT基因座涉及的体细胞结构变异/重排现象同样普遍存在,其中肉瘤的发生频率最高(22%)。TERT重排机制在神经母细胞瘤中研究得最为透彻[5]。
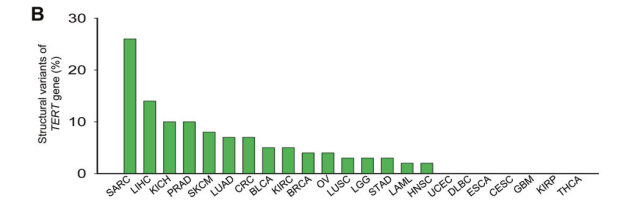
图6 TERT基因结构变异在各癌种中分布频率[5]
(3)拷贝数变异
在神经母细胞瘤细胞中,我们观察到TERT基因含有超过100个TERT拷贝。在其他肿瘤中,经常检测到TERT基因座的局灶性拷贝增加或扩增。
分析了TCGA队列中包括6835名患者、覆盖31种肿瘤类型的TERT基因扩增情况发现在卵巢癌、肾上腺皮质癌、食管癌、肺腺癌和鳞状细胞癌中具有高频率TERT扩增[5]。
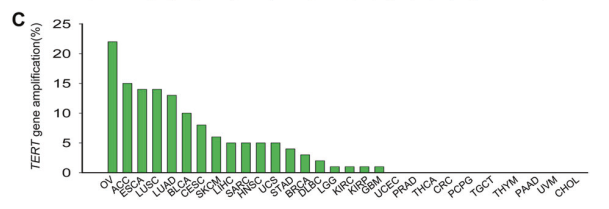
图7 TERT拷贝数变异在各癌种中分布频率[5]
(4)病毒DNA
病毒DNA整合到TERT基因座是TERT调控的又一种新机制。肝细胞癌(HCC)细胞通过劫持TERT基因位点上的整合乙型肝炎病毒(HBV)启动子或增强子,获得了端粒逆转录酶(TERT)的过表达和端粒酶的激活[5]。
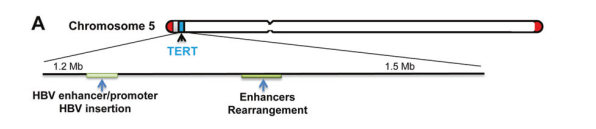
图8 HBV病毒DNA整合到TERT基因座激活TERT基因的表达[5]
(5)其他变异
单核苷酸多态性(single nucleotide polymorphisms,SNPs)与多种癌症的发生有关,它们可能位于端粒酶逆转录酶(TERT)的内含子和外显子序列中,也可能位于端粒酶活性位点(TERTp)中,一些常见的端粒酶逆转录酶(TERT)SNPs可能改变某些癌症的生存率和预后。
位于TERT基因内含子2的rs 2736100 A>C是一个重要的非编码SNP,它与多种癌症相关(尤其是肺腺癌),其特征是TERT基因表达、端粒酶活性和基因拷贝数显著增加。
位于TERT基因外显子2的rs2736098 G>A变异,在肾细胞癌患者中发现GG基因型与较长的端粒和较低的癌症易感性相关。另有研究表明,携带rs2736098 A等位基因的中国男性比携带G等位基因的中国男性患肺癌的风险更高。在北印度人群中,等位基因A也与膀胱癌风险显著相关。进一步的研究表明,该变异可能与患其他癌症的风险相关[5]。
四
TERT与肿瘤的关联
1
TERT基因与神经母细胞瘤
在高危神经母细胞瘤的发病中,端粒维持机制至关重要,其通过稳定端粒使肿瘤细胞获得无限增殖和永生化能力。主要有两种途径,其一是端粒酶依赖途径:核心是TERT基因激活,已知激活方式包括TERT突变和TERT基因座重排(TERT-RA)。其中,TERT-RA近年才被发现,与肿瘤侵袭性表型相关。
研究TERT启动子突变和重排组相应的生总生存期(OS)为16.5±2个月和56.8±8.6个月,两组的无进展生存期(PFS)无差异。
2
TERT基因与皮肤黑色素瘤
2013年,在对黑色毒瘤全基因组测序研究中首次发现了TERT启动子突变,并分别命名为C228T和C250T。在原发性黑色素瘤患者中,有39.2%的肿瘤存在TERTp突变,归因于紫外线辐射。它们与患者年龄增加、远端转移、预后差以及总生存期(OS)和无病生存期(DFS)受损相关。
3
TERT基因与甲状腺癌
TERT 启动子突变是甲状腺癌强有力的预后生物标志物,与肿瘤侵袭性显著相关。在甲状腺癌中,其启动子突变频率与甲状腺癌组织学类型相关。其中间变性甲状腺癌(ATC)和弥漫性硬化型甲状腺乳头状癌(DSVPTC)突变率较高,而在良性肿瘤、NIFTP、MTC中均未检出TERT突变。在该癌种中最常见的突变是C228T,其发生频率远高于C250T。
在甲状腺癌中,TERT突变通常不单独作为“驱动突变”,而常与BRAF或RAS等驱动基因突变共存。RAF V600E突变可通过激活MAPK通路上调ETS转录因子家族,而TERT启动子突变恰好产生了新的ETS结合位点,二者协同导致TERT过度表达。
TERT 启动子突变是甲状腺癌,尤其是高侵袭性亚型(如ATC、DSVPTC)的一个关键分子特征,是独立且强大的不良预后指标。将其整合进甲状腺癌的分子诊断图谱,有助于实现更精准的风险分层和个体化管理[6]。
4
TERT基因与肝癌
《中国肝癌早筛策略专家共识》(2021)中阐明了TERT对于肝癌诊断的重要性。TERT 启动子区变异在低级别和高级别肝脏增生性结节中经常出现,被认为是肝癌发生的早期分子事件,可作为潜在的辅助临床诊断标志物[7]。
在肝癌中,TERT的再激活途径非常多样,涵盖了从遗传变异到表观遗传和病毒整合等多个层面。其中TERT启动子突变(最主要机制),同样是C228T和C250T这两个热点突变,与甲状腺癌相同。
乙型肝炎病毒(HBV)整合是HBV相关HCC的关键致癌机制,这是肝癌特有的机制。HBV DNA常整合到宿主基因组TERT基因座附近,其病毒增强子/启动子元件可直接激活TERT的表达[8]。
总的来说,TERT变异,特别是其启动子区域的突变,它在癌症诊断分型、预后评估和风险分层方面已具有明确的临床实用价值。虽然直接靶向TERT的治疗仍在发展,但其作为预后标志物已作为多种实体瘤(尤其是甲状腺癌、胶质瘤、肝癌、膀胱癌)的临床管理策略。对患者进行TERT突变检测,有助于实现更个体化、更精准的癌症诊疗。
五
TERT 靶向药物的潜在策略和分子机制
癌细胞与正常细胞的不同就在于其能够通过激活端粒维持机制(TMM)来延长端粒,实现复制永生。人体内除了部分干细胞群,正常的体细胞缺乏端粒维持机制,这意味着癌细胞的端粒维持机制具有高度特异性,是非常有吸引力的药物开发靶点。端粒维持机制主要有两种,一种是依赖于端粒酶机制,一种涉及同源定向修复(HDR)途径,称为端粒替代延长(ALT)[10]。
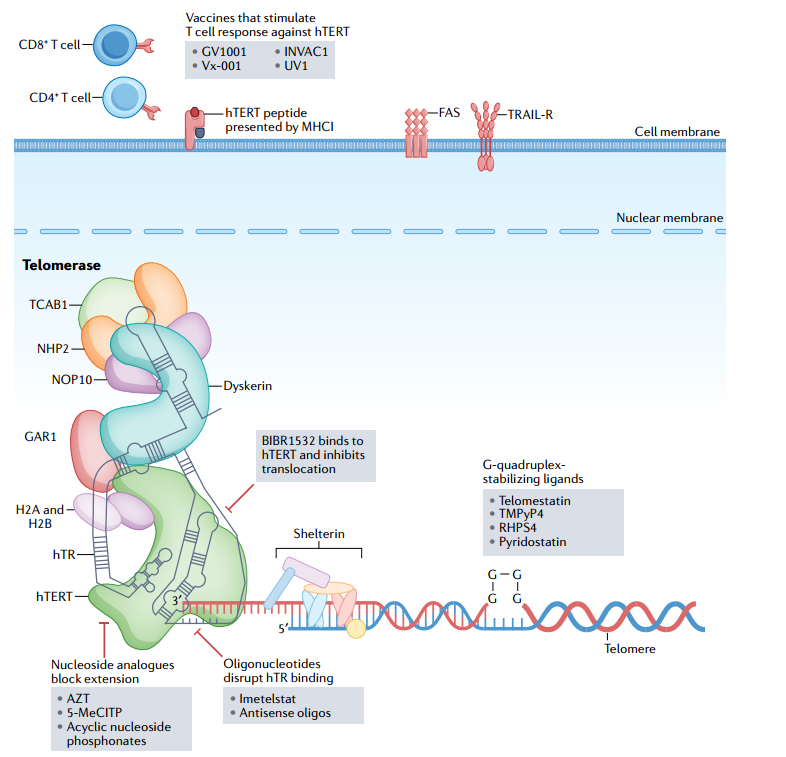
图9 端粒酶靶向的治疗策略[10]
端粒酶靶向的治疗策略
1
抗hTR的寡核苷酸
作用机制:端粒合成可被抑制hTR(端粒酶RNA组分)功能的寡核苷酸阻断。这些寡核苷酸目标作用于hTR的模板区。当两者结合时可以有效地抑制端粒重复加成的催化作用。脂质基团的添加可以提高寡核苷酸的细胞渗透性和生物利用度,竞争性结合hTR序列模板以抑制端粒酶活性。
该类型药物已在不同肿瘤模型中显示出体内和体外疗效,进入II期临床试验后,FDA将其指定为复发性或难治性骨髓纤维化治疗药物。但该药物对于人类其他癌症类型的抑制作用还有待于观察。
2
核苷类似物
作用机制:核苷类似物通过端粒酶与端粒末端共价结合,由于缺乏3′-OH功能团,从而阻止进一步核苷酸的添加。
目前已有的核苷类似物包括叠氮胸苷(AZT,FDA批准用于治疗HIV)、6-thio-dG和5-MeCITP。
3
hTERT小分子抑制剂
作用机制:BIBR1532和MST-312是目前最有前景的hTERT小分子抑制剂。BIBR1532在非催化位点与hTERT结合,从而非竞争性抑制端粒酶活性。在临床前研究中,BIBR1532已对包括乳腺癌、纤维肉瘤、子宫内膜癌和白血病等多种癌细胞具有有效作用。
MST-312则是通过阻断hTERT基因的转录,诱导hTERT表达下调、端粒酶活性降低和端粒缩短,从而导致细胞周期停滞和凋亡。MST-312可治疗各种癌症类型的细胞,包括乳腺癌、肺癌和结肠癌。
4
针对hTERT的免疫治疗
目前针TERT疫苗有GV1001、UV1、INVAC 1。
作用机制:癌细胞可以加工内源性hTERT,并通过主要组织相容性复合体(MHC)I和II分子将hTERT肽呈递到细胞表面。hTERT疫苗通常是一种短肽,将其注射到真皮中,在真皮中树突细胞将抗原呈递给淋巴结中的CD4+ T细胞。这些hTERT特异性TH 1细胞(CD4+ T细胞亚群)迁移到肿瘤中,在肿瘤中它们刺激CD8+ T细胞对抗表达hTERT的癌细胞的活性,或通过释放细胞因子或肿瘤坏死因子相关凋亡诱导配体(TRAIL)凋亡诱导受体相互作用直接杀死癌细胞。
5
G4稳定配体
已经开发了许多G4稳定配体,包括端粒抑制素、TMPyP4、RHPS4和吡咯他汀,它们在抑制端粒酶结合和加工性的能力上有很大差异。
作用机制:G4配体是通过抑制端粒酶与端粒DNA的结合而成为端粒酶活性的负调节剂。
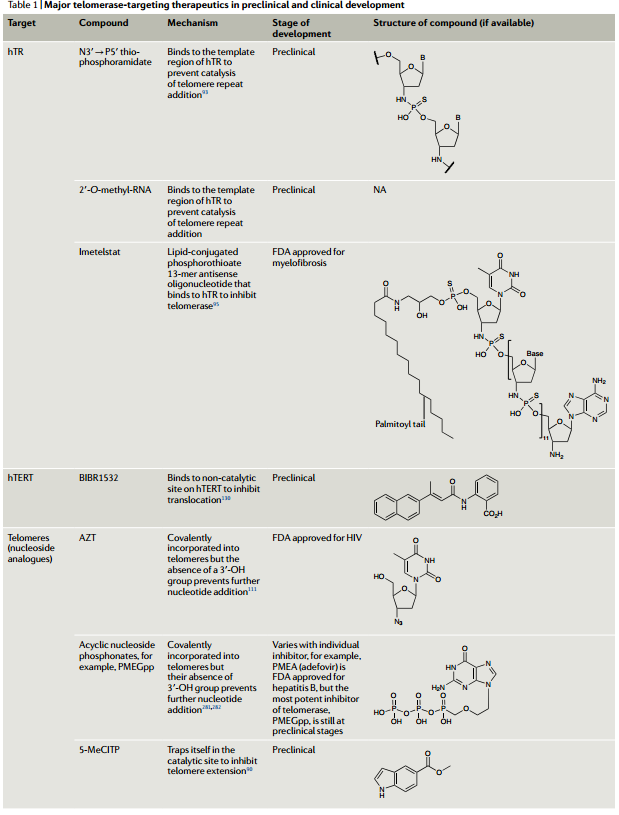
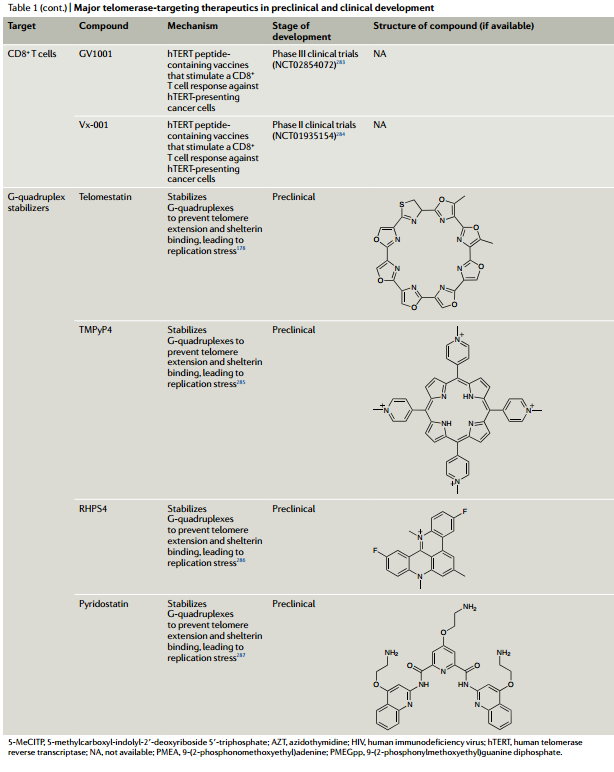
图10 临床前和临床开发中的主要端粒酶靶向疗法[10]
6
RNA 干扰(RNAi)、反义寡核苷酸(ASOs)和基因编辑 CRISPR
作用机制:基于RNAi的疗法涉及使用小RNA分子选择性降解TERT mRNA,降低 TERT 蛋白水平。小干扰 RNA(siRNAs)或短发夹 RNA(shRNAs)被用于靶向TERT。这些分子通过病毒载体或基于纳米颗粒的系统递送。
ASOs (反义寡核苷酸),可与互补RNA序列结合,导致RNA降解或剪接改变。ASOs 可靶向 TERT mRNA 并降低其表达。它们通过全身给药或瘤内给药。
CRISPR 介导的基因编辑技术已被用于靶 TERT。靶向破坏 GABPβ1L 以及将 突变的TERT启动子恢复为野生型,分别导致端粒丢失介导的细胞死亡和 TERT 表达降低[2]。
针对ALT途径的治疗策略
由于ALT中的相关因素对正常的DNA复制和修复也至关重要,因此许多ALT阳性癌症的药物治疗都集中在寻找药物靶点上,这些靶点一旦被抑制,就会对ALT阳性癌症产生选择性毒性。许多研究观察到ALT激活可以作为长期抗端粒酶治疗后的耐药机制,这意味着端粒酶阳性肿瘤患者在复发后可能需要ALT靶向治疗。
1
PARP抑制剂
PARP抑制剂通过诱导合成致死作用,在HR缺陷型癌症(如BRCA 1或BRCA 2突变的乳腺癌和卵巢癌)中具有特殊用途。在这些癌症类型中,PARP抑制剂将PARP结合并捕获到DNA上,阻断复制叉进展并导致DNA损伤。
在ALT阳性的癌细胞中,PARP抑制剂导致TRF2与端粒分离,从而刺激不适当的非同源末端连接修复,这导致小鼠致死性端粒融合,并导致ALT阳性颅内星形细胞瘤的凋亡和生长受损。几种PARP抑制剂目前已被FDA批准用于治疗HR缺陷型乳腺癌、卵巢癌、胰腺癌和转移性前列腺癌。
2
复制应激调节剂
ALT阳性细胞具有特征性的高水平端粒特异性复制应激,使ALT介导的HDR途径永久化。ALT阳性细胞的端粒复制应激水平得到了很好的平衡,以实现端粒长度和细胞生存能力的维持。靶向阻止复制应激的蛋白质或复制应激反应途径的成分有可能造成端粒DNA损伤,并对ALT阳性癌症类型提供选择性毒性。
六
总结
TERT基因是编码端粒酶逆转录酶的核心基因,其核心功能是合成端粒重复序列,以维持染色体末端的稳定。在正常成体细胞中,其活性受到严格限制;而在超过90%的恶性肿瘤中,TERT通过多种机制被异常重新激活,赋予癌细胞无限增殖的潜能,成为癌症发生发展的关键分子。
TERT的激活机制复杂多样,主要包括启动子区热点突变(如C228T和C250T,约占31%)、表观遗传修饰(如启动子高甲基化,约占53%)、基因扩增、染色体结构重排以及病毒DNA整合(如在肝癌中的HBV整合)等。这些改变导致TERT表达失控,端粒酶活性异常增高。
在临床上,TERT突变是多种实体瘤(如甲状腺癌、胶质瘤、肝癌、膀胱癌、黑色素瘤)中公认的强预后不良标志物,与肿瘤侵袭性增强、复发风险升高和患者生存期缩短显著相关。尤其在甲状腺癌中,TERT突变常与BRAF等驱动突变协同,加剧肿瘤恶性进展。
靶向端粒是治疗绝大多数癌症较为有前景的一种方法,当前策略主要分为两大类:一是直接靶向端粒酶复合物(如开发hTERT小分子抑制剂、针对端粒酶RNA的寡核苷酸、免疫疗法等);二是针对不依赖端粒酶的替代性端粒延长(ALT)途径(如使用PARP抑制剂)。这些研究为开发新型抗癌药物提供了重要方向。
参考文献
1. Dratwa M, Wysoczańska B, Łacina P, Kubik T, Bogunia-Kubik K. TERT-Regulation and Roles in Cancer Formation. Front Immunol. 2020 Nov 19;11:589929. doi: 10.3389/fimmu.2020.589929.
2. Murugan AK, Kannan S, Alzahrani AS. TERT promoter mutations in gliomas: Molecular roles in tumorigenesis, metastasis, diagnosis, prognosis, therapeutic targeting, and drug resistance. Biochim Biophys Acta Rev Cancer. 2025 Feb;1880(1):189243. doi: 10.1016/j.bbcan.2024.189243.
3. Shim HS, Iaconelli J, Shang X, Li J, Lan ZD, Jiang S, Nutsch K, Beyer BA, Lairson LL, Boutin AT, Bollong MJ, Schultz PG, DePinho RA. TERT activation targets DNA methylation and multiple aging hallmarks. Cell. 2024 Jul 25;187(15):4030-4042.e13. doi: 10.1016/j.cell.2024.05.048.
4. Hafezi F, Perez Bercoff D. The Solo Play of TERT Promoter Mutations. Cells. 2020 Mar 19;9(3):749. doi: 10.3390/cells9030749.
5. Yuan X, Larsson C, Xu D. Mechanisms underlying the activation of TERT transcription and telomerase activity in human cancer: old actors and new players. Oncogene. 2019 Aug;38(34):6172-6183. doi: 10.1038/s41388-019-0872-9.
6. Maloberti T, Repaci A, Poppi L, Di Paola FJ, Calafato G, Coluccelli S, Carosi F, Colapinto A, Colombero S, Credi G, Tallini G, Pantaleo MA, Nannini M, de Biase D. Exploring the role of TERT in thyroid Cancer: A systematic review. Crit Rev Oncol Hematol. 2025 Sep;213:104792. doi: 10.1016/j.critrevonc.2025.104792.
7. In der Stroth L, Tharehalli U, Günes C, Lechel A. Telomeres and Telomerase in the Development of Liver Cancer. Cancers (Basel). 2020 Jul 24;12(8):2048. doi: 10.3390/cancers12082048.
8. Yeh SH, Li CL, Lin YY, Ho MC, Wang YC, Tseng ST, Chen PJ. Hepatitis B Virus DNA Integration Drives Carcinogenesis and Provides a New Biomarker for HBV-related HCC. Cell Mol Gastroenterol Hepatol. 2023;15(4):921-929. doi: 10.1016/j.jcmgh.2023.01.001. Epub 2023 Jan 20.
9. Jafri MA, Ansari SA, Alqahtani MH, Shay JW. Roles of telomeres and telomerase in cancer, and advances in telomerase-targeted therapies. Genome Med. 2016 Jun 20;8(1):69. doi: 10.1186/s13073-016-0324-x.
10. Gao J, Pickett HA. Targeting telomeres: advances in telomere maintenance mechanism-specific cancer therapies. Nat Rev Cancer. 2022 Sep;22(9):515-532. doi: 10.1038/s41568-022-00490-1.


