中国人群研究 | Lp(a)与ASCVD患者极高风险分层人群中的不良预后更相关
- boke
- 2024-12-06
- 5:55 下午
脂蛋白(a) [Lp(a)] 作为动脉粥样硬化性心脑血管疾病 (ASCVD) 的新兴预测指标,其与当前风险分层的关系尚不明确。基于中国人群Lp(a)的广泛研究表明,它在心脑血管问题调节中具有普遍性和独特性。
ASCVD患的不同个体的复发情况和不良后果差异很大,在最新的研究中[1],研究人员连续测量了一组中国 ASCVD患者的 Lp(a) 血浆水平,并旨在基于当前指南细分的风险分层,前瞻性地考察Lp(a)水平与心脑血管事件之间的关系,探索Lp(a)在ASCVD危险分层中的作用。

该研究招募了9944名患有ASCVD的中国患者,并根据当前指南,将其分为极高风险 (VHR) 和非极高风险 (non-VHR) 亚组。
ASCVD 的细分风险分层根据:2018 年美国心脏协会/美国心脏病学院胆固醇指南[2]。
VHR 亚组患者定义为:患有2次及以上主要ASCVD事件 (VHR-1)或1次主要事件和 2 种以上高危因素 (VHR-2)。
非VHR定义为:其他ASCVD患者。
主要ASCVD事件包括:过去12个月内被诊断为急性冠脉综合征(ACS)、既往心梗史(上述ACS除外)、缺血性脑卒中史、有症状的外周动脉疾病。
Lp(a) 血浆浓度根据其浓度 (<30, 30–50, 50–75 和 ≥75 mg/dL) 和百分位范围 (<25th, 25–50th, 50–75th, 75–90th, ≥90th) 进行划分。
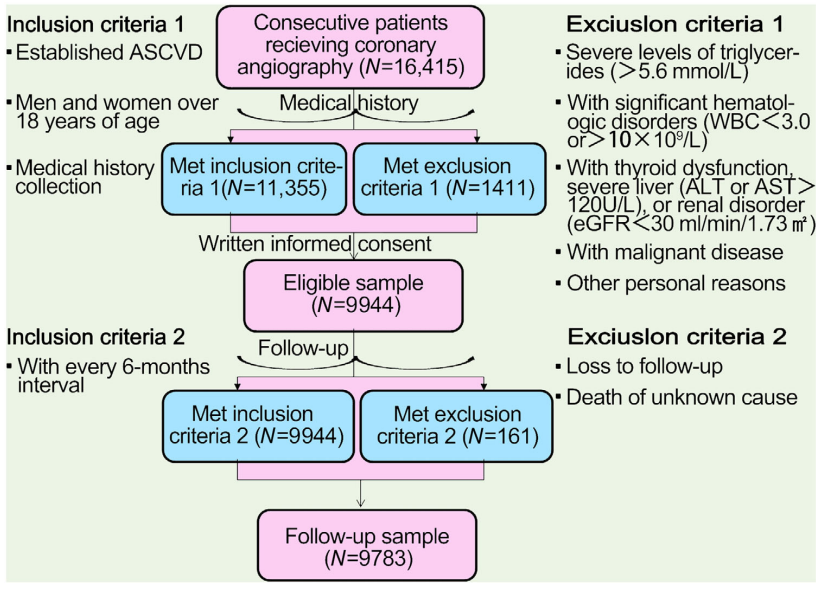
平均随访38.5 个月后,记录了心脑血管事件 (CVE)。
根据当前ASCVD风险分层,各组Lp (a)水平的分布如下图所示,Lp (a)值分别按百分位数(第25、50、75、90和95)进行统计以及Lp (a)为<30、30−50、50−75、75−100和≥100 mg/dL的占比。
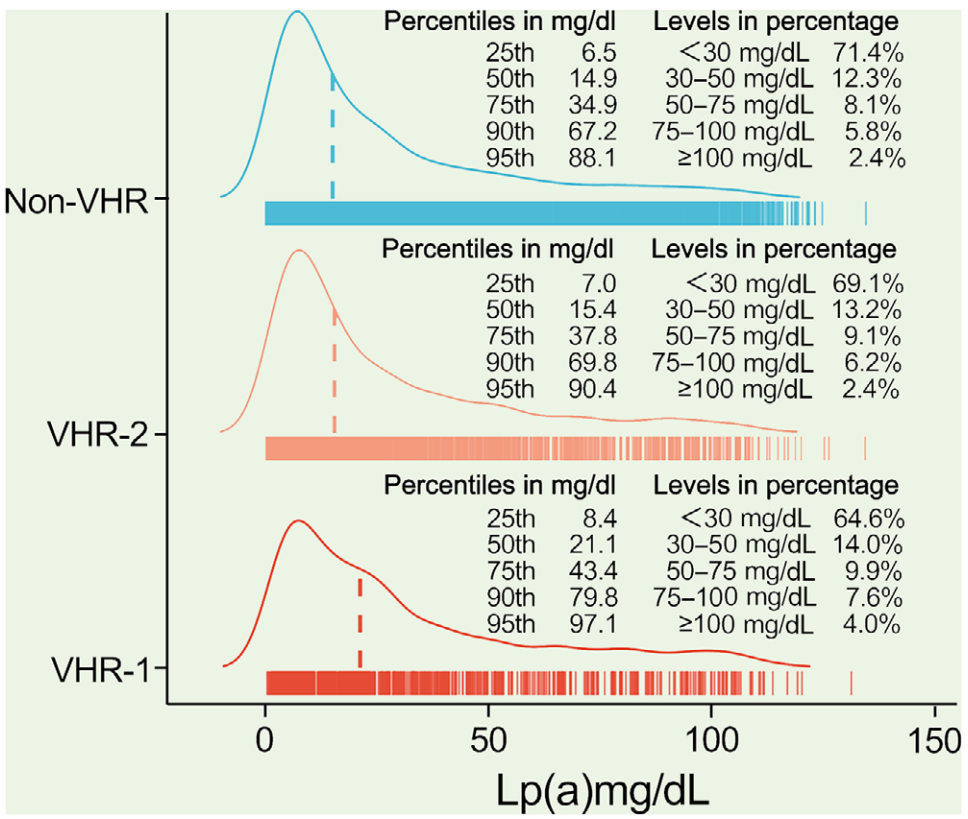
研究发现,ASCVD 风险分层越高,Lp(a) 水平越高。在VHR 亚组中,Lp(a) 水平越高,CVE发生率显著上升,但在非VHR亚组中则没有。
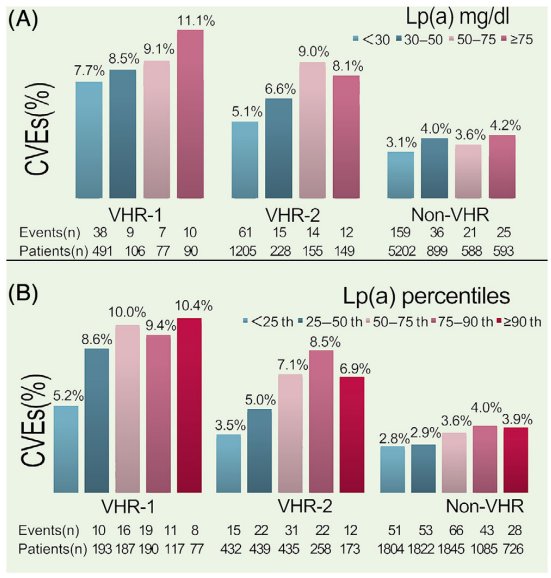
按照Lp(a)浓度绝对值进行分组,校正后的CVE风险比在总体人群中,Lp(a) ≥75 mg/dL 的最高组与 Lp(a) <30 mg/dL 的对照组相比为1.75倍,在VHR亚组中为 2.18 倍,在非 VHR 亚组中为 1.43 倍。

按照Lp(a)浓度百分位分组:<25th, 25−50th, 50−75th, 75−90th, ≥90th
按照Lp(a)浓度百分位进行分组,在Lp(a)最高水平 (≥90th 百分位) 处,校正后的风险比在总体人群中为1.72倍,在VHR亚组中为2.83倍,在非VHR亚组中为1.38倍。这些结果表明,在极高风险亚组中,Lp(a)对CVE风险的影响可能更大。
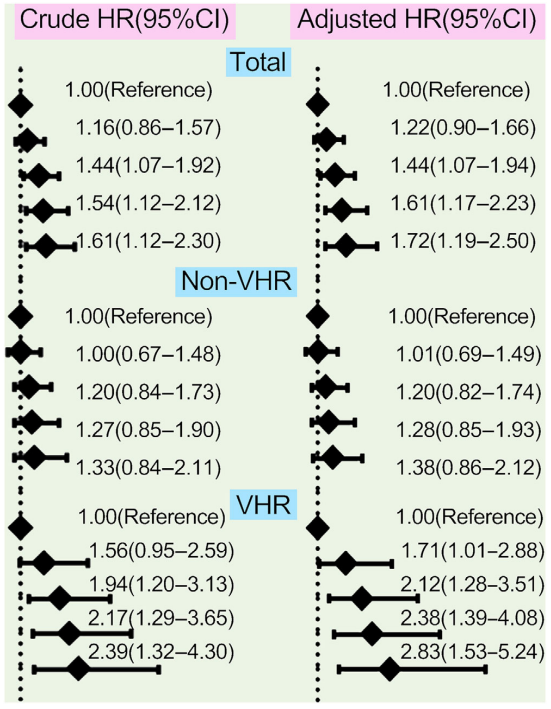
按照Lp(a)浓度百分位分组:<25th, 25−50th, 50−75th, 75−90th, ≥90th
讨论
随着我们对ASCVD认知的深入,当前胆固醇指南中风险分层的细化已得到更新。然而,较少关注 Lp(a) 水平与不同风险分层 ASCVD 亚组之间的关联。
本研究首次揭示了 Lp(a) 与当前 ASCVD 风险分层之间的关联,并强调了 Lp(a) 在不同风险分层患者中心脑血管事件复发风险的重要作用,表明风险分层越高,Lp(a) 与心脑血管事件的相关性越强。
首先,基于当前指南修订的 ASCVD 风险组中,Lp(a) 水平呈上升趋势,显示高风险分层患者的循环 Lp(a) 水平可能更高。
其次,在 Lp(a) 水平高或风险分层较高患者中,无论其他危险因素如何,心脑血管事件的发生率和风险均显著增加,这强调了在临床管理中将 Lp(a) 与 ASCVD 风险分层结合起来的重要性。
第三,在高危患者 (VHR) 中,Lp(a) 升高对心脑血管事件风险预测的价值显而易见,但在非高危患者 (non-VHR) 中则不然。Lp(a) 的测量和管理可能更有价值,与非VHR 患者相比,较低的 Lp(a) 临界值可能有助于进一步降低 VHR 患者的心脑血管事件风险。
此外,在目前研究期间,没有药物能够有效降低患者的 Lp(a) 水平。大多数受试者正在服用他汀类药物,可能轻微影响循环 Lp(a),但其临床意义不大。蛋白酶体亚基抑制剂 (PCSK9i) 已成为降低 Lp(a) 的治疗方法,但在研究患者入组时尚未上市。
因此,本研究中的 Lp(a) 可以被视为未经治疗的情况。本研究的新发现表明,在高危患者 (VHR) 中,Lp(a) 水平的升高与明显的血管疾病风险相关,无论采用百分位数还是浓度区间定义 Lp(a),结果都一致。特别是,即使 Lp(a) 水平在正常范围内略有增加,在 VHR 患者中,心脑血管事件风险也显著增加。这些发现不仅符合当前关于及时测量 Lp(a) 的建议,也支持对高危患者进行严格的Lp(a)管理,以获得更好的心脑血管益处。
然而,在非VHR患者中,该研究没有观察到高Lp(a)水平和低Lp(a)水平患者之间的HR存在显著差异。考虑到不同种族/民族之间 Lp(a) 水平的差异,这些结果可能无法推广到其他环境,Lp(a) 与该亚组患者长期 ASCVD 风险的关联仍有待进一步研究。
这一点在关于 Lp(a) 与其他动脉粥样硬化表型相关的类似结果也已观察到。例如,Mehta等人的研究表明,在冠状动脉钙化(CAC)患者中,升高的Lp(a)可以分层ASCVD风险,而CAC缺失的患者则不然,CAC是动脉粥样硬化的标志。Kaiser 等人的另一项研究表明,高 Lp(a) 与低衰减斑块表型的进展有关,但在高 Lp(a) 组和低 Lp(a) 组之间,这些更稳定的斑块表型的进展没有差异。
该研究结果提供了进一步证据,支持利用Lp(a)来识别高危患者,并可能支持Lp(a)的识别对于更好地定制ASCVD患者,特别是高危患者的风险降低策略至关重要。
局限性
首先,这是一项单中心、具有心血管专科性质的研究,入组患者主要为冠心病患者,患有其他心脑血管事件的个体数量相对较少。因此,本研究结果的推广性和代表性可能有限。
其次,数据主要来自病历,但部分病症的隐私和数据完整性存在限制。例如,家族性高脂血症(FH)是根据临床诊断而非基因检测确定的,我们无法扩大样本量并延长随访时间。
第三,Lp(a)水平会因种族/民族而异,且生物化学评估缺乏标准化。Lp(a)升高的遗传决定因素可能有助于辨别Lp(a)相关心脑血管事件的风险,而仅凭血浆测量往往无法得出明确结论。本研究只关注了Lp(a)的循环水平,没有考虑其遗传因素,也没有评估随访期间的动态变化。
在研究期间,PCSK9抑制药在中国尚未上市或普遍应用。未来在PCSK9抑制药时代,对Lp(a)治疗后心血管事件风险(特别是高危心血管事件,VHR-ASCVD)进行全面评估将具有重要价值。
最后,目前的研究主要关注Lp(a)与不同风险分层的心血管事件之间的关联,但没有建立常规的预测模型。Lp(a)的准确值和ASCVD风险分层在复发性心血管事件预测中的作用可能需要进一步研究和重新评估。
总之,本研究首次揭示了Lp(a)血浆水平与当前指南修订的ASCVD风险分层之间的关系。Lp(a)可能被视为比低密度脂蛋白胆固醇(LDL-C)更坏的脂质成分,并且在不同ASCVD风险分层患者的心血管事件风险方面存在差异。
该研究结果补充了中国人群中当前ASCVD精细化和Lp(a)联合用于预测心血管事件的知识。总而言之,ASCVD风险分层细化对于关联评估和最佳预防指导至关重要,Lp(a)对高危组的风险贡献可能更大。
参考文献
1. Prognostic role of lipoprotein(a) in atherosclerotic cardiovascular disease risk from a perspective on current risk stratification. Med Comm, 31 October 2024
2. Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/ AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. J Am Coll Cardiol. 2019;73(24):e285-e350.
推荐阅读
这是示例文本,单击 “编辑” 按钮更改此文本。
DROSHA和肿瘤易感性
DROSHA的体细胞突变常在肾母细胞瘤中发现。这些突变发生在DROSHA的RNase IIIb结构域中,会破坏金属离子结合和核酸内切酶活性,导致包括肿瘤抑制因子let-7家族在内的多种miRNA水平降低。肾母细胞瘤与胚系DROSHA变异R967W相关,表明此类突变可能使个体易患某些肿瘤。DROSHA的杂合缺失突变对miRNA产生影响很小。相反,DROSHA的RNase IIIb结构域的杂合突变表现出显性负效应,显着抑制let-7家族和其他miRNA的产生,同时仍允许足够的残余miRNA加工来支持肿瘤生长。DROSHA变异也已在两名患有严重智力障碍、癫痫、白质萎缩、小头畸形和畸形特征的个体中观察到。
DGCR8与甲状腺癌
DGCR8位于22q11.2染色体区域。在甲状腺癌中,DGCR8中反复出现的变异为c.1552G>A (p.E518K)。E518K变异导致成熟miRNA水平降低,与正常DGCR8相比,导致肿瘤中关键miRNA表达降低,这种降低与沉默DGCR8促进肿瘤生长的发现一致。此外,DGCR8 E518K突变已在散发性滤泡性甲状腺癌病例中观察到,其中额外的功能丧失(LOF)突变或杂合性丧失(LOH)似乎对于致癌作用是必要的。
DICER1综合征
DICER1综合征包括一系列罕见肿瘤,包括胸膜肺芽瘤(PPB)和囊性肾母细胞瘤,以及更常见的甲状腺功能正常的结节性甲状腺肿(MNG)。该综合征的GPV通常是功能丧失(LOF)变异,最常见的是无义突变或移码突变。为了使该综合征表现出来,DICER1基因中必须发生第二次遗传改变。第二次突变通常是错义变异,影响RNase IIIb结构域中关键残基(“热点”),这些残基对于金属离子结合和核酸内切酶活性至关重要。虽然不那么常见,但第二次打击也可能是剩余DICER1等位基因的杂合性丧失(LOH)。
Argonaute (AGO) 蛋白在神经发育障碍 (NDD) 中的作用
哺乳动物中,四种 Argonaute (AGO) 蛋白——AGO1、AGO2、AGO3 和 AGO4—是 miRNA 介导的基因调控的核心组成部分。这些蛋白是 RISC 的核心组成部分,它们结合单链 miRNA 并引导其到达靶标 mRNA。AGO1 和 AGO2 的基因变异与多种神经发育障碍 (NDD) 相关,包括智力障碍、发育迟缓和言语障碍,这些变异削弱了其通过miRNA调控基因表达的功能。
Lessel 等人发现,在患有 NDD 的患者中,AGO2中存在 13 种新的遗传变异,其中大部分是错义突变。功能实验表明,这些变异不同程度地削弱了AGO2的沉默功能,主要表现为功能缺失。值得注意的是,这些变异并未影响 AGO2 的剪切活性;相反,它们破坏了其与靶标 mRNA 分离的能力。这导致 mRNA 持续结合时间延长,并最终损害了基因调控。
类似地,Schalk 等人报告了 NDD 受试者中 AGO1 的各种基因变异,强调了它们对神经发育的影响。这些 AGO1 变异,包括错义突变和小缺失,与智力障碍和其他在 AGO 相关疾病中常见的临床特征相关。
最近的研究表明,AGO1 和 AGO2 可能参与 miRNA 靶向降解,该机制调节细胞内 miRNA 的周转和积累。AGO1 或 AGO2 变异导致 miRNA 水平失调,可能会导致基因表达模式改变,从而促成 NDD 的发病机制。
从临床角度来看,AGO1 和 AGO2 变异的鉴定扩展了我们对 NDD 基因基础的理解,突出了遗传检测在患有不明原因神经发育或心脏异常的患者中的重要性。这有助于医生根据受影响个体的特定基因谱提供更准确的诊断、个性化的治疗策略和家庭咨询。
MIR96 和耳聋
非综合征性耳聋 (NSHL) 是一种遗传性疾病,其特征是听力障碍,无其他症状,影响大约每 1000 名新生儿中 1 人,以及每 1000 名青少年中 3 人以上。
该疾病具有基因多样性,超过 120 种已识别的基因或基因座参与其中。与 NSHL 相关的特定基因座是 DFNA50,位于 7q32 染色体上。最初的测序并未在此基因座中发现编码基因中的致病突变。然而,对 miRNA 基因 MIR96 的全面遗传分析(该基因也位于该基因座内)发现了两个与西班牙两大家族中的 NSHL 相关的突变。这些突变表现出显性遗传。
MIR96 在耳蜗内毛细胞和外毛细胞中表达,对于它们的差异化至关重要,并在听觉后脑的发育中发挥作用。MIR96 中的突变会影响成熟 miRNA (miR-96-5p) 的种子序列,这对于识别和结合靶标 mRNA 至关重要。
西班牙家系:种子序列中的 n.13G>A 和 n.14C>A 突变会影响靶标识别。Luciferase reporter assay证实了这些突变 miRNA 对野生型 miRNA 靶标的沉默活性下降。这些突变还会影响 miRNA 前体结构的稳定性,导致 miR-96-5p 水平下降。
DROSHA和肿瘤易感性
DROSHA的体细胞突变常在肾母细胞瘤中发现。这些突变发生在DROSHA的RNase IIIb结构域中,会破坏金属离子结合和核酸内切酶活性,导致包括肿瘤抑制因子let-7家族在内的多种miRNA水平降低。肾母细胞瘤与胚系DROSHA变异R967W相关,表明此类突变可能使个体易患某些肿瘤。DROSHA的杂合缺失突变对miRNA产生影响很小。相反,DROSHA的RNase IIIb结构域的杂合突变表现出显性负效应,显着抑制let-7家族和其他miRNA的产生,同时仍允许足够的残余miRNA加工来支持肿瘤生长。DROSHA变异也已在两名患有严重智力障碍、癫痫、白质萎缩、小头畸形和畸形特征的个体中观察到。
DGCR8与甲状腺癌
DGCR8位于22q11.2染色体区域。在甲状腺癌中,DGCR8中反复出现的变异为c.1552G>A (p.E518K)。E518K变异导致成熟miRNA水平降低,与正常DGCR8相比,导致肿瘤中关键miRNA表达降低,这种降低与沉默DGCR8促进肿瘤生长的发现一致。此外,DGCR8 E518K突变已在散发性滤泡性甲状腺癌病例中观察到,其中额外的功能丧失(LOF)突变或杂合性丧失(LOH)似乎对于致癌作用是必要的。
DICER1综合征
DICER1综合征包括一系列罕见肿瘤,包括胸膜肺芽瘤(PPB)和囊性肾母细胞瘤,以及更常见的甲状腺功能正常的结节性甲状腺肿(MNG)。该综合征的GPV通常是功能丧失(LOF)变异,最常见的是无义突变或移码突变。为了使该综合征表现出来,DICER1基因中必须发生第二次遗传改变。第二次突变通常是错义变异,影响RNase IIIb结构域中关键残基(“热点”),这些残基对于金属离子结合和核酸内切酶活性至关重要。虽然不那么常见,但第二次打击也可能是剩余DICER1等位基因的杂合性丧失(LOH)。
Argonaute (AGO) 蛋白在神经发育障碍 (NDD) 中的作用
哺乳动物中,四种 Argonaute (AGO) 蛋白——AGO1、AGO2、AGO3 和 AGO4—是 miRNA 介导的基因调控的核心组成部分。这些蛋白是 RISC 的核心组成部分,它们结合单链 miRNA 并引导其到达靶标 mRNA。AGO1 和 AGO2 的基因变异与多种神经发育障碍 (NDD) 相关,包括智力障碍、发育迟缓和言语障碍,这些变异削弱了其通过miRNA调控基因表达的功能。
Lessel 等人发现,在患有 NDD 的患者中,AGO2中存在 13 种新的遗传变异,其中大部分是错义突变。功能实验表明,这些变异不同程度地削弱了AGO2的沉默功能,主要表现为功能缺失。值得注意的是,这些变异并未影响 AGO2 的剪切活性;相反,它们破坏了其与靶标 mRNA 分离的能力。这导致 mRNA 持续结合时间延长,并最终损害了基因调控。
类似地,Schalk 等人报告了 NDD 受试者中 AGO1 的各种基因变异,强调了它们对神经发育的影响。这些 AGO1 变异,包括错义突变和小缺失,与智力障碍和其他在 AGO 相关疾病中常见的临床特征相关。
最近的研究表明,AGO1 和 AGO2 可能参与 miRNA 靶向降解,该机制调节细胞内 miRNA 的周转和积累。AGO1 或 AGO2 变异导致 miRNA 水平失调,可能会导致基因表达模式改变,从而促成 NDD 的发病机制。
从临床角度来看,AGO1 和 AGO2 变异的鉴定扩展了我们对 NDD 基因基础的理解,突出了遗传检测在患有不明原因神经发育或心脏异常的患者中的重要性。这有助于医生根据受影响个体的特定基因谱提供更准确的诊断、个性化的治疗策略和家庭咨询。
MIR96 和耳聋
非综合征性耳聋 (NSHL) 是一种遗传性疾病,其特征是听力障碍,无其他症状,影响大约每 1000 名新生儿中 1 人,以及每 1000 名青少年中 3 人以上。
该疾病具有基因多样性,超过 120 种已识别的基因或基因座参与其中。与 NSHL 相关的特定基因座是 DFNA50,位于 7q32 染色体上。最初的测序并未在此基因座中发现编码基因中的致病突变。然而,对 miRNA 基因 MIR96 的全面遗传分析(该基因也位于该基因座内)发现了两个与西班牙两大家族中的 NSHL 相关的突变。这些突变表现出显性遗传。
MIR96 在耳蜗内毛细胞和外毛细胞中表达,对于它们的差异化至关重要,并在听觉后脑的发育中发挥作用。MIR96 中的突变会影响成熟 miRNA (miR-96-5p) 的种子序列,这对于识别和结合靶标 mRNA 至关重要。
西班牙家系:种子序列中的 n.13G>A 和 n.14C>A 突变会影响靶标识别。Luciferase reporter assay证实了这些突变 miRNA 对野生型 miRNA 靶标的沉默活性下降。这些突变还会影响 miRNA 前体结构的稳定性,导致 miR-96-5p 水平下降。


