载脂蛋白与疾病(APOE)
- boke
- 2024-05-28
- 3:47 下午
血脂是血清中的胆固醇、甘油三酯(Triglyceride,TG)和类脂(如磷脂)等的总称,与临床密切相关的血脂主要是胆固醇和 TG。由于血脂不溶于水,因此必须与特殊的蛋白质,即载脂蛋白(apoprotein,Apo),结合形成脂蛋白才能溶于血液,并被运输至组织进行代谢[1]。
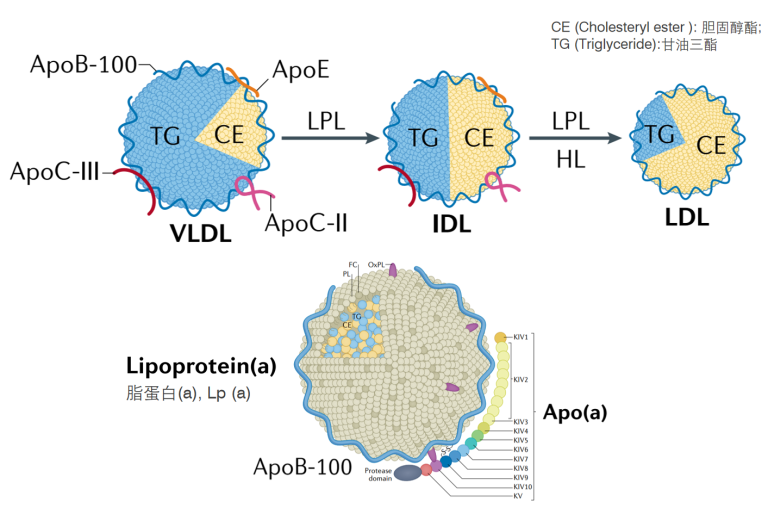
不同脂蛋白结合的载脂蛋白[2]
按照脂蛋白进行分类,包括乳糜微粒(chylomicron,CM)、极低密度脂蛋白(very low-density lipoprotein,VLDL)、中间密度脂蛋白(intermediate-density lipoprotein,IDL)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)和 脂蛋白(a)[ Lipoprotein(a), Lp(a)]。
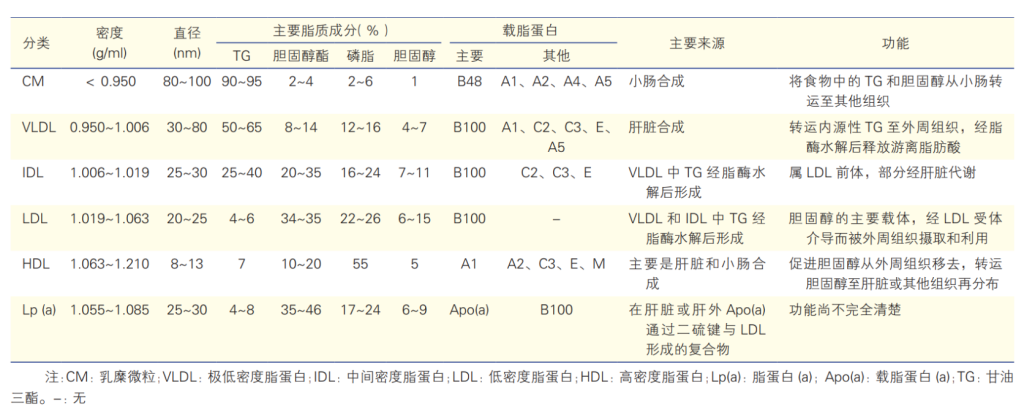
脂蛋白的物理及生物学特性和功能[1]
按照载脂蛋白进行分类,包括载脂蛋白B-100 (ApoB-100)、载脂蛋白B-48 (ApoB-48)、载脂蛋白A-I (ApoA- I)、载脂蛋白C-II (ApoC-II)、载脂蛋白C-III (ApoC-I II)、载脂蛋白E (ApoE)、以及载脂蛋白(a)[Apo(a)]等。
不同的脂蛋白,其结合的载脂蛋白种类会存在差异。例如,极低密度脂蛋白(VLDL)除结合载脂蛋白ApoB-100外,还包括ApoC-II、ApoC-III和ApoE等载脂蛋白;低密度脂蛋白(LDL)由VLDL转化而来,但LDL中的载脂蛋白95% 以上为ApoB-100,而脂蛋白(a)[Lipoprotein(a), Lp(a)]则包括Apo-B100和Apo(a)两种载脂蛋白。载脂蛋白在人体胆固醇稳态中发挥着重要作用,一旦发生功能变异,则会导致严重的疾病。
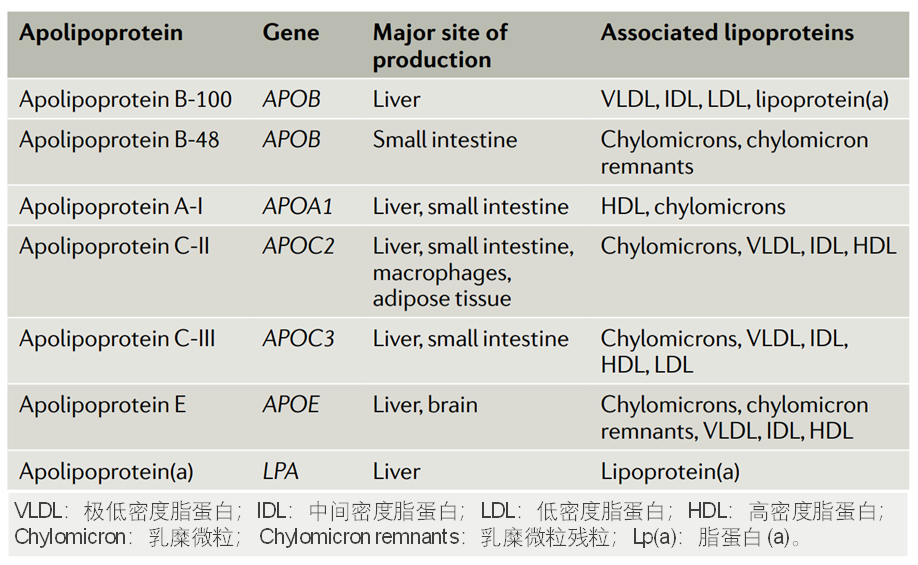
载脂蛋白的编码基因、合成组织和相关的脂蛋白[2]
富含甘油三酯的脂蛋白(TRL)
VLDL(very low-density lipoprotein,VLDL)由肝脏合成,其TG含量约占 50%~65%。由于 VLDL 分子比CM小,TG正常时,空腹12h的血清清亮透明,当空腹血清TG水平>3.4 mmol/L 时,血清呈乳状光泽直至混浊。
乳糜微粒(chylomicron,CM)由小肠合成,是血液中颗粒最大的脂蛋白,主要成分是TG (甘油三酯)。正常人空腹12h 后采血时,血清中无CM。餐后以及某些病理状态下血液中含有大量 CM 时,血液外观白色混浊,称为“乳糜血”。
VLDL和CM一起统称为富含甘油三酯的脂蛋白(Triglyceride-Rich Lipoprotein,TRL),TG含量丰富。ApoB是TRL最主要的结构蛋白。含有 ApoB-100 的 VLDL由肝脏合成后,可被代谢成 VLDL 残粒、IDL 和LDL。含有 ApoB-48 的 CM 由小肠合成,直径较大,可代谢为 CM 残粒。
TRL及其残粒与 ASCVD 风险相关。在使用他汀类药物治疗的人群中,TRL仍是除LDL-C 以外的脂质相关心血管剩余风险的因素之一,特别是部分特殊人群如糖尿病患者等[1]。
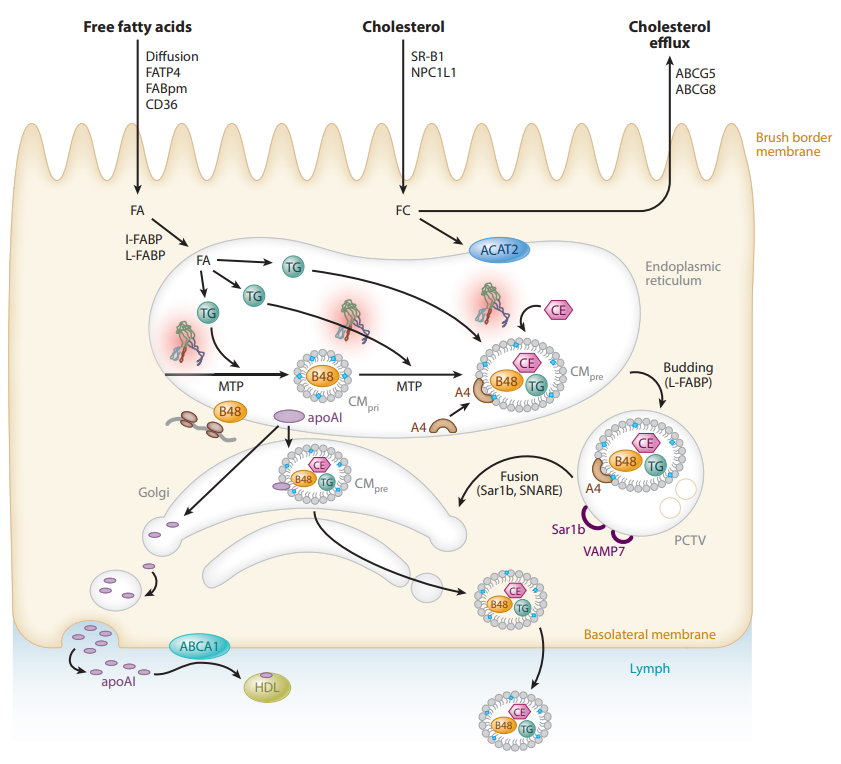
乳糜微粒(chylomicron,CM)的组装与分泌[3]
ApoE与脂质代谢
ApoE与乳糜微粒、乳糜微粒残粒、VLDL、IDL和HDL相关。ApoE在TRL代谢中具有重要作用,因为它与LDLR(低密度脂蛋白受体)、LRP1(低密度脂蛋白受体相关蛋白1)和VLDLR(极低密度脂蛋白受体)具有高亲和力结合,从而促进肝脏对残余颗粒的摄取。
ApoE与LDLR结合的效率比ApoB-100高近20倍,这也解释了相对于不含有ApoE的LDL颗粒(LDL中,95%的载脂蛋白为ApoB-100),TRL颗粒的快速清除。当脂肪过多时,ApoE也会相应上升,临床上常见于高血脂症。
细胞表面的硫酸乙酰肝素蛋白多糖(HSPG)在携带ApoE的脂蛋白颗粒的结合中也具有重要作用,从而促进其受体介导的清除。此外,几项研究表明,载脂蛋白ApoC-III可以从TRL表面置换或阻断ApoE与肝细胞表面受体结合。因此,脂蛋白表面的ApoC-III与ApoE的比例也被认为是TRL残粒代谢的重要调节因子。
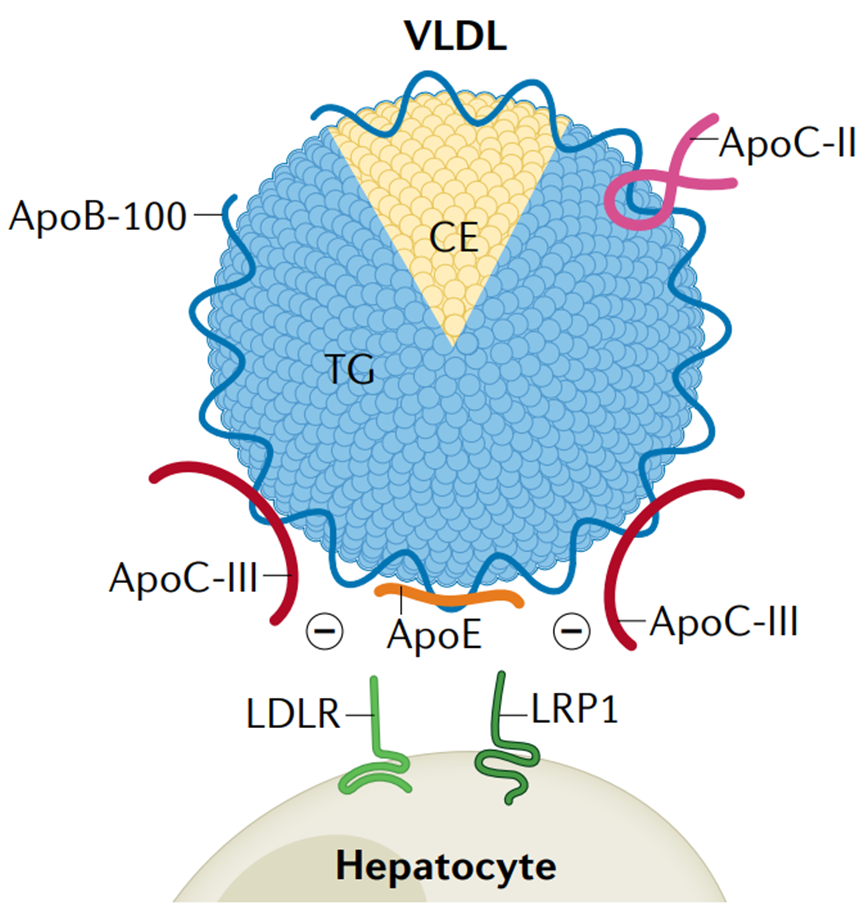
ApoC-III通过置换阻断ApoE与LDLR或LRP1受体结合抑制肝脏摄取TRL残粒[2]
家族性异常β脂蛋白血症(Familial dysbetalipoproteinemia, FD)又名Ⅲ型高脂蛋白血症,其患者的VLDL电泳时常移至β位置,而不是正常的前β位置,因而称这种VLDL为β-VLDL。由于β-VLDL是Ⅲ型高脂蛋白血症的最突出表现,且具有明显的家族聚集性,所以称之为家族性异常β脂蛋白血症。

正常VLDL在电泳中的位置[4]
家族性异常β脂蛋白血症的特征是血浆总胆固醇和甘油三酯水平升高,高密度脂蛋白胆固醇水平低,黄色瘤和早发性ASCVD,其致病基因包括APOE基因。ApoE有三种不同的亚型:ApoE-ε3(包含cys112和arg158;最常见)、ApoE-ε2(cys112和cys158)和ApoE-ε4(arg112和arg158)。这些异构体彼此之间的差异在于一个或两个氨基酸。
家族性异常β脂蛋白血症是由多因素异常所致,只有一小部分(15%)具有ApoE-ε2纯合性的个体出现家族性β脂蛋白血症,而肥胖、胰岛素抵抗、甲状腺功能减退和更年期等次要风险因素是疾病表型表现所必需的[2]。
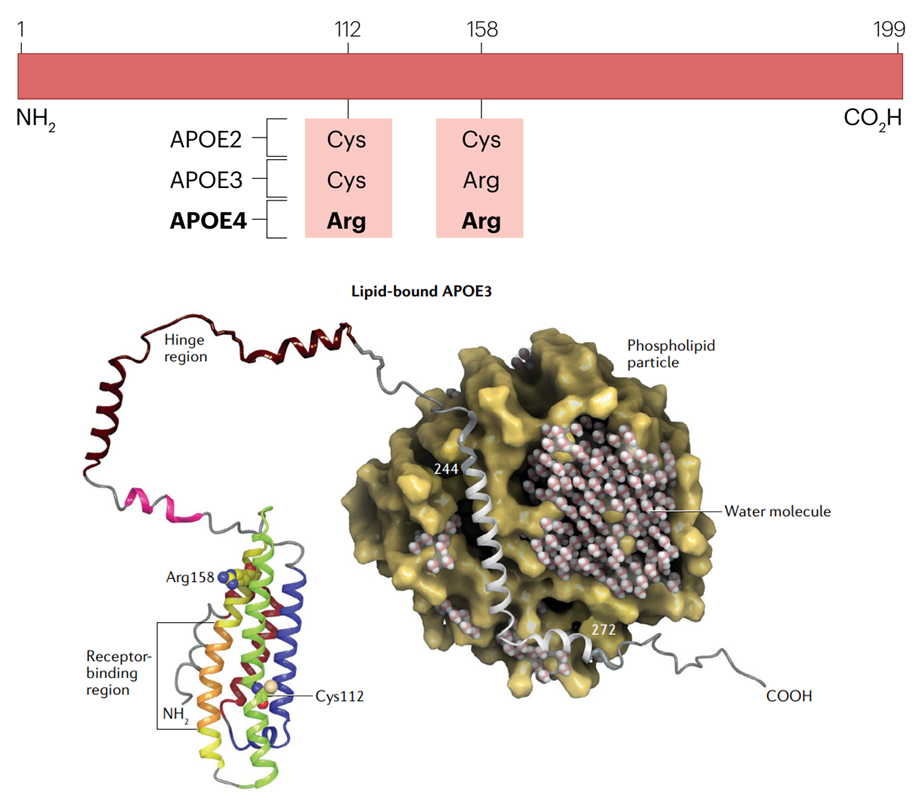
ApoE的3种不同亚型以及氨基酸差异[5、6]
不同于其他载脂蛋白在肝脏和小肠合成,ApoE主要产生于肝脏和大脑。因此,ApoE除了在脂蛋白代谢和血管生物学中发挥核心作用外,在中枢神经系统生物学中也发挥着至关重要的作用。
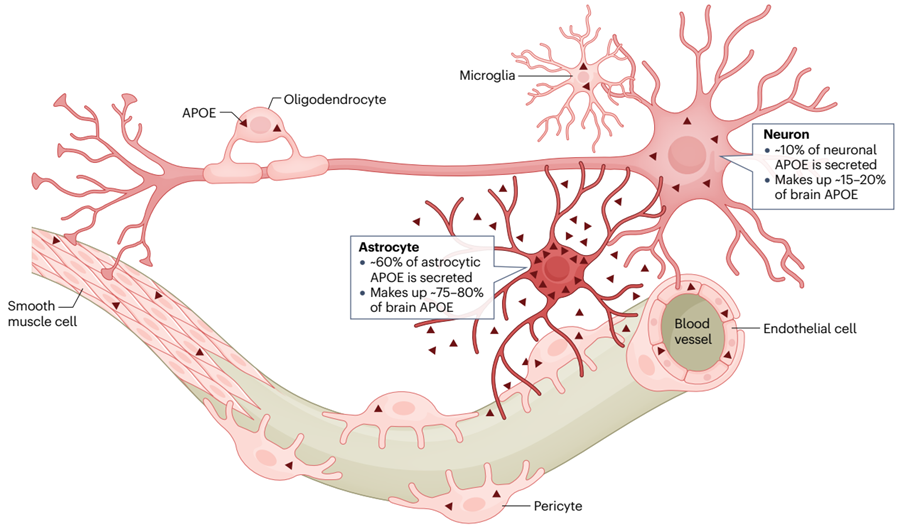
ApoE在中枢神经系统细胞的表达[5]
ApoE与阿尔兹海默病
阿尔茨海默病(AD)的复杂性和多因素性是其临床研究以及开发治疗方法的独特挑战。从遗传学上看,三个基因的突变(APP、PSEN1和PSEN2)将导致早发性常染色体显性阿尔茨海默病(ADAD),而在唐氏综合征中的APP基因的三倍体导致与唐氏综合征相关的阿尔茨海默病(DSAD)。值得注意的是,ADAD与DSAD这两种遗传性AD占所有病例的很小一部分,而散发的迟发性阿尔茨海默病占据了全球大多数AD病例。
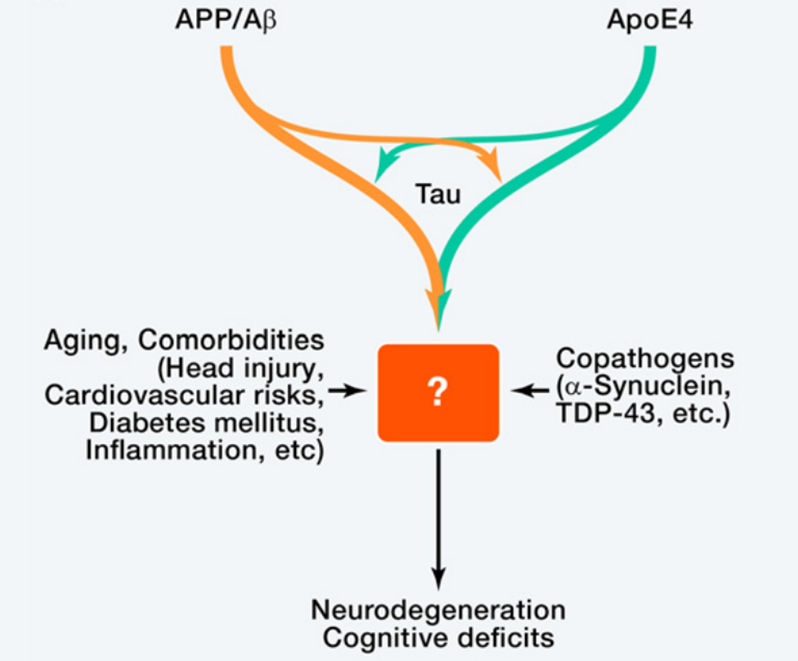
阿尔茨海默病(AD)可能是由多种因素共同作用引起的,包括APP/Aβ、apoE4、Tau等以及各种并发症。它们究竟是如何协同损害神经元功能和存活的,还有待确定。[7]
大量研究已经证实,APOE4亚型的存在是淀粉样蛋白-β(Aβ)在大脑中的胞外沉积以及散发的迟发性阿尔茨海默病(AD)的最强大的遗传风险因素,但是在大型APOE4纯合性患者队列中还缺乏详细的研究,以准确确定该基因型在AD发展中的作用。
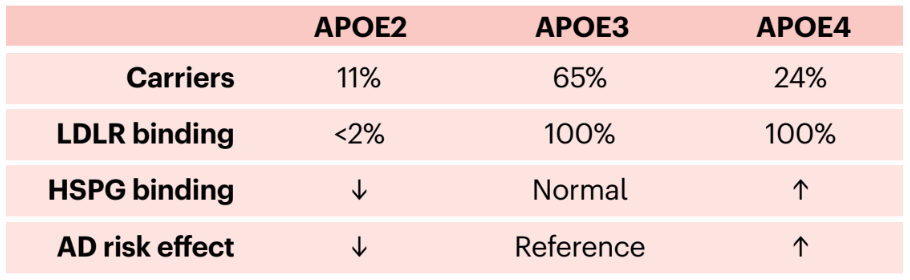
3种APOE亚型的携带率、LDLR/HSPG结合能力以及AD的发病风险[5]
近日,《自然医学》发布的研究结果提供了全面的证据支持将APOE4纯合子重新概念化为一类遗传性阿尔茨海默病的形式,类似于ADAD和DSAD[8]。APOE4纯合子占总人口的约2%,占所有AD病例的15%, APOE4纯合子AD很可能是全球最常见的孟德尔遗传病之一。
该研究分析了美国国家阿尔茨海默病协调中心(NACC)的大规模病理学数据集(N=3,297,包括273名APOE4纯合子患者)以及来自三个国家的多中心阿尔茨海默病生物标志数据的五个临床数据集(N=10,039,包括519名APOE4纯合子患者)。
数据表明,APOE4纯合子AD患者满足遗传性阿尔茨海默病的三个主要特征—即近乎完全的外显率、症状发作年龄的可预测性以及可预测的生物标志物变化顺序。
研究发现,几乎所有的APOE4纯合子表现出AD病理学,并且从55岁开始,其AD生物标志物水平明显高于APOE3纯合子。到了65岁,几乎所有APOE4纯合子的脑脊液中都有异常淀粉样蛋白水平,75%的人在淀粉样蛋白扫描中呈阳性,这些标志物的患病率随年龄增长而增加,表明APOE4纯合子中AD生物学的近乎完全外显。APOE4纯合子的症状发作年龄比APOE3纯合子早,为65.1岁。
将APOE4纯合子重新定义为一种遗传形式的阿尔茨海默病将对阿尔茨海默病的诊断、研究和治疗发展产生重大影响。
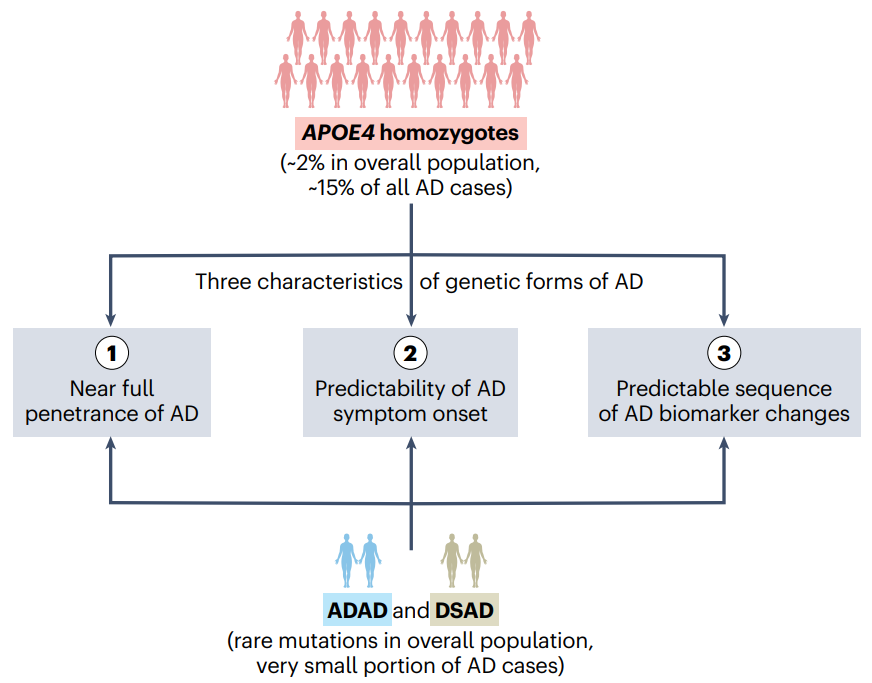
定义阿尔茨海默病的遗传形式[9]
ApoE与他汀降脂疗效
他汀类药物的有效性存在个体差异。研究证实,ApoE基因多态性影响血清总胆固醇、甘油三酯水平,进而影响他汀类药物的降脂效果。他汀类药物通过影响肝细胞表面LDLR的表达使其反馈性增加,使血液中总胆固醇及LDL-C清除增加、水平降低,ApoE作为配体与LDL-R结合,从而影响他汀类药物降脂疗效。
其中,ApoE-ε2使用他汀类药物治疗时血总胆固醇和LDL-C降幅更大,降脂疗效较佳;而ApoE-ε4其携带者血脂水平更高,服用他汀类药物往往疗效不佳或无效[10]。
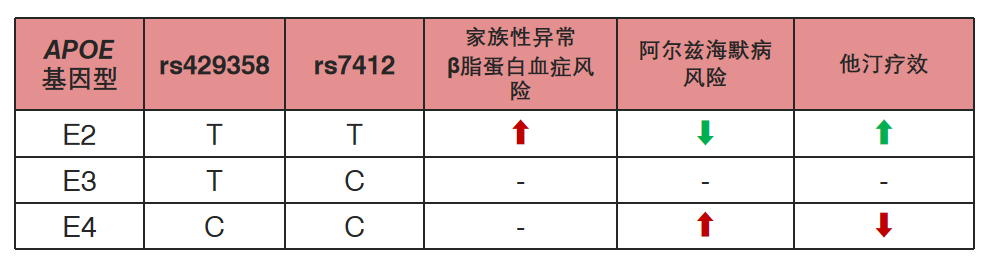
参考资料
1. 中国血脂管理指南(2023 年). 中国循环杂志 2023 年 3 月 第 38 卷 第 3 期(总第 297 期)
2. Mehta A, Shapiro M D. Apolipoproteins in vascular biology and atherosclerotic disease[J]. Nature Reviews Cardiology, 2022, 19(3): 168-179.
3. Dash S, Xiao C, Morgantini C, et al. New insights into the regulation of chylomicron production[J]. Annual review of nutrition, 2015, 35: 265-294.
4. Koopal C, Marais A D, Visseren F L J. Familial dysbetalipoproteinemia: an underdiagnosed lipid disorder[J]. Current Opinion in Endocrinology, Diabetes and Obesity, 2017, 24(2): 133-139.
5. Blumenfeld J, Yip O, Kim M J, et al. Cell type-specific roles of APOE4 in Alzheimer disease[J]. Nature Reviews Neuroscience, 2024: 1-20.
6. Yamazaki Y, Zhao N, Caulfield T R, et al. Apolipoprotein E and Alzheimer disease: pathobiology and targeting strategies[J]. Nature Reviews Neurology, 2019, 15(9): 501-518.
7. Huang Y, Mucke L. Alzheimer mechanisms and therapeutic strategies[J]. Cell, 2012, 148(6): 1204-1222.
8. Fortea J, Pegueroles J, Alcolea D, et al. APOE4 homozygozity represents a distinct genetic form of Alzheimer’s disease[J]. Nature Medicine, 2024: 1-8.
9. Xu Q, Liang Z, Huang Y. APOE4 homozygosity is a new genetic form of Alzheimer’s disease[J]. Nature Medicine, 2024: 1-2.
10. SLCO1B1和ApoE基因多态性检测与他汀类药物临床应用专家共识. 中华检验医学杂志, 2023,46(7) : 672-680.


