载脂蛋白与疾病(APOA1)
- boke
- 2024-06-07
- 5:34 下午
血脂是血清中的胆固醇、甘油三酯(Triglyceride,TG)和类脂(如磷脂)等的总称,与临床密切相关的血脂主要是胆固醇和 TG。由于血脂不溶于水,因此必须与特殊的蛋白质,即载脂蛋白(apoprotein,Apo),结合形成脂蛋白才能溶于血液,并被运输至组织进行代谢[1]。
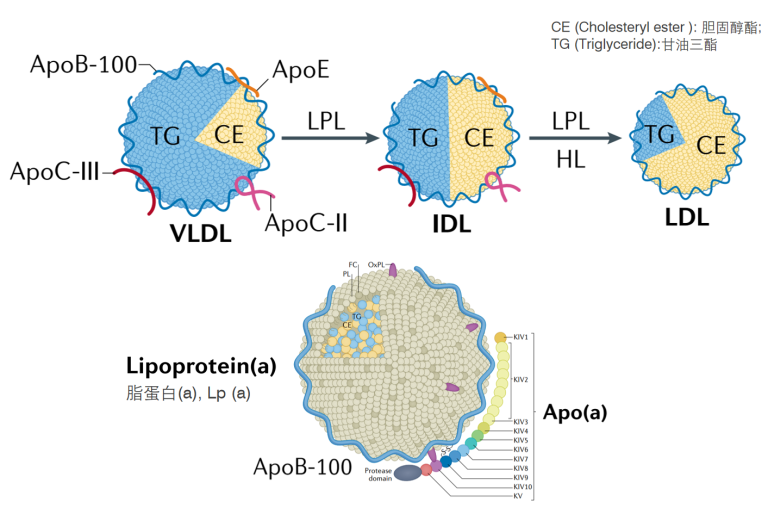
不同脂蛋白结合的载脂蛋白[2]
按照脂蛋白进行分类,包括乳糜微粒(chylomicron,CM)、极低密度脂蛋白(very low-density lipoprotein,VLDL)、中间密度脂蛋白(intermediate-density lipoprotein,IDL)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)和 脂蛋白(a)[ Lipoprotein(a), Lp(a)]。
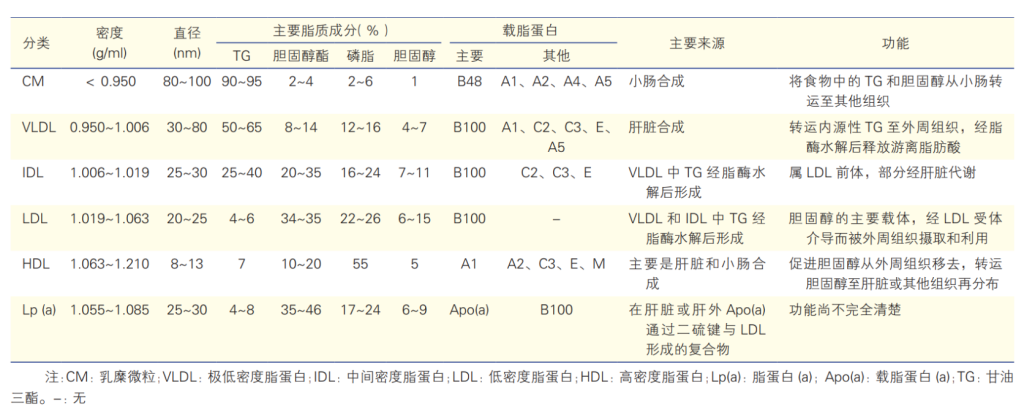
脂蛋白的物理及生物学特性和功能[1]
按照载脂蛋白进行分类,包括载脂蛋白B-100 (ApoB-100)、载脂蛋白B-48 (ApoB-48)、载脂蛋白A-I (ApoA-I)、载脂蛋白C-II (ApoC-II)、载脂蛋白C-III (ApoC-III)、载脂蛋白E (ApoE)、以及载脂蛋白(a)[Apo(a)]等。
不同的脂蛋白,其结合的载脂蛋白种类会存在差异。例如,极低密度脂蛋白(VLDL)除结合载脂蛋白ApoB-100外,还包括ApoC-II、ApoC-III和ApoE等载脂蛋白;低密度脂蛋白(LDL)由VLDL转化而来,但LDL中的载脂蛋白95% 以上为ApoB-100,而脂蛋白(a)[Lipoprotein(a), Lp(a)]则包括Apo-B100和Apo(a)两种载脂蛋白。载脂蛋白在人体胆固醇稳态中发挥着重要作用,一旦发生功能变异,则会导致严重的疾病。
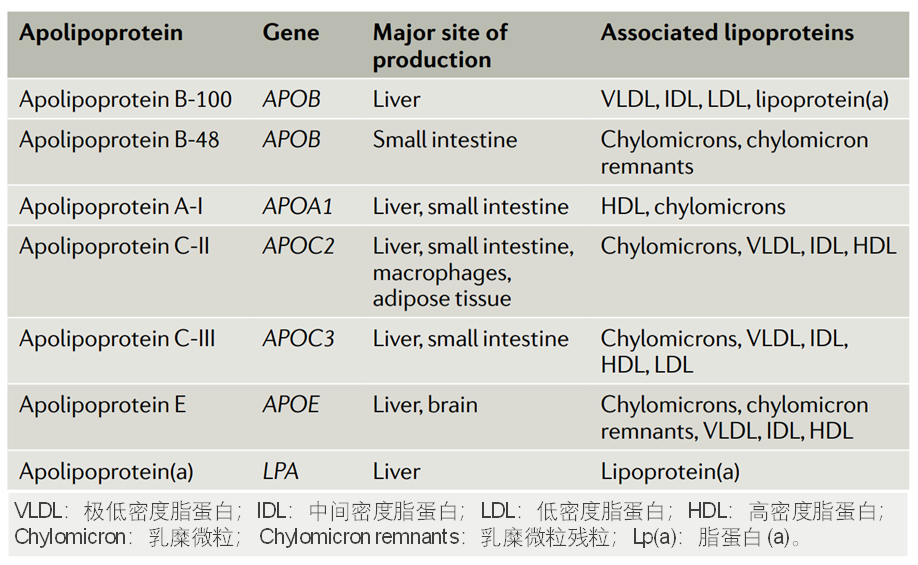
载脂蛋白的编码基因、合成组织和相关的脂蛋白[2]
富含甘油三酯的脂蛋白(TRL)
VLDL(very low-density lipoprotein,VLDL)由肝脏合成,其TG含量约占 50%~65%。由于 VLDL 分子比CM小,TG正常时,空腹12h的血清清亮透明,当空腹血清TG水平>3.4 mmol/L 时,血清呈乳状光泽直至混浊。
乳糜微粒(chylomicron,CM)由小肠合成,是血液中颗粒最大的脂蛋白,主要成分是TG (甘油三酯)。正常人空腹12h 后采血时,血清中无CM。餐后以及某些病理状态下血液中含有大量 CM 时,血液外观白色混浊,称为“乳糜血”。
VLDL和CM一起统称为富含甘油三酯的脂蛋白(Triglyceride-Rich Lipoprotein,TRL),TG含量丰富。ApoB是TRL最主要的结构蛋白。含有 ApoB-100 的 VLDL由肝脏合成后,可被代谢成 VLDL 残粒、IDL 和LDL。含有 ApoB-48 的 CM 由小肠合成,直径较大,可代谢为 CM 残粒。
TRL及其残粒与 ASCVD 风险相关。在使用他汀类药物治疗的人群中,TRL仍是除LDL-C 以外的脂质相关心血管剩余风险的因素之一,特别是部分特殊人群如糖尿病患者等[1]。
脂蛋白脂肪酶 (Lipoprotein lipase, LPL )
脂蛋白脂肪酶 (Lipoprotein lipase, LPL ) 是脂肪细胞、心肌细胞、骨骼肌细胞、乳腺细胞以及巨噬细胞等实质细胞合成和分泌的一种糖蛋白,活性LPL以同源二聚体形式存在,通过静电引力与毛细血管内皮细胞表面的多聚糖结合。LPL生理功能是催化CM和VLDL核心的TG分解为脂肪酸和单酸甘油酯,以供组织氧化供能和贮存。LPL在毛细血管内皮主要作用于血浆中的TRL。
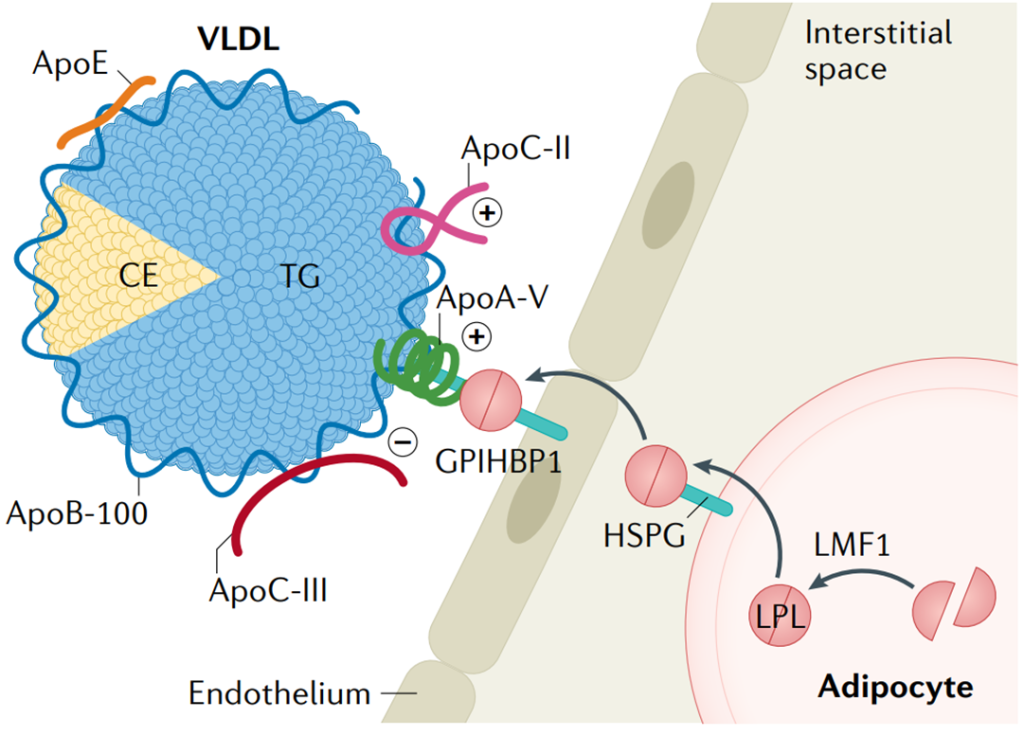
ApoC-II和ApoC-III在TRL代谢中的作用。LPL水解富含甘油三酯的脂蛋白(TRL)中所含的甘油三酯(TG)。脂蛋白脂酶(LPL)在脂肪细胞、骨骼肌细胞和心肌细胞中合成。LPL被LMF1激活,并通过GPIHBP1与HSPG一起转运到内皮表面。ApoC-II和ApoA-V刺激LPL活性,而ApoC-III起到抑制剂的作用[2]。
LPL激活因子-ApoC-II
ApoC-II是一种可溶性载脂蛋白,含有79个氨基酸,与CM、VLDL、IDL和HDL颗粒相关。ApoC-II主要在肝脏和肠道中产生,巨噬细胞和脂肪组织是其额外的产生位点。
ApoC-II是一种重要的LPL辅因子,通过促进TG进入活性酶位点来促进脂解,LPL需与ApoC-II结合后才发挥其脂解活性。
研究表明,TRL表面压力在控制脂蛋白颗粒、LPL和apoC-II之间的相互作用中起着重要作用。LPL和ApoC-II很容易以低表面压力与新分泌的乳糜微粒或VLDL颗粒结合,并随着脂解后脂蛋白表面压力增加,从脂蛋白中转移。
ApoC-II由APOC2基因编码,APOC2的纯合或复合杂合破坏性变异是家族性乳糜微粒血症综合征的罕见原因,其特征是由LPL激活不足导致无法分解代谢TRL,导致的非常严重的高甘油三酯血症。该综合征可导致反复发作的急性胰腺炎、视网膜脂血症和发疹性黄瘤。家族性乳糜微粒血症综合征的致病基因还包括LPL、APOA5等基因。
LPL抑制因子-ApoC-III
ApoC-III是一种可溶性载脂蛋白,主要在肝脏和肠道中产生。ApoC-III含有79个氨基酸,与CM、VLDL、IDL、HDL以及在较小程度上与LDL颗粒有关。ApoC-III通过多种机制影响血管生物学和动脉粥样硬化。
1)ApoC-III通过阻止脂蛋白颗粒结合到LPL所在的细胞表面并通过将主要的LPL激活因子apoC-II从脂蛋白表面置换来抑制LPL介导的脂解(上图)。
2)ApoC-III抑制ApoE介导的TRL残粒在肝脏的清除(下图)。

ApoC-III通过将载脂蛋白E(ApoE)从脂蛋白表面置换并阻止其与肝细胞上的LDL受体(LDLR)和LDL相关蛋白1(LRP1)相互作用来抑制肝脏中TRL残余摄取[2]。
3)ApoC-III通过促进LDL在内皮下空间的滞留和聚集,以及通过促进动脉壁中的炎症级联反应和平滑肌细胞增殖,影响动脉粥样硬化的发展。
ApoC-III由APOC3基因编码,APOC3变异产生的功能缺失型ApoC-III,与血浆ApoC-III以及甘油三酯水平的降低有关。2014年,《新英格兰医学杂志》发表的两项分子遗传学研究显示,缺失功能型APOC3携带者比非携带者发生ASCVD事件的风险更低(下图),这表明ApoC-III可能是高甘油三酯潜在的治疗靶点。
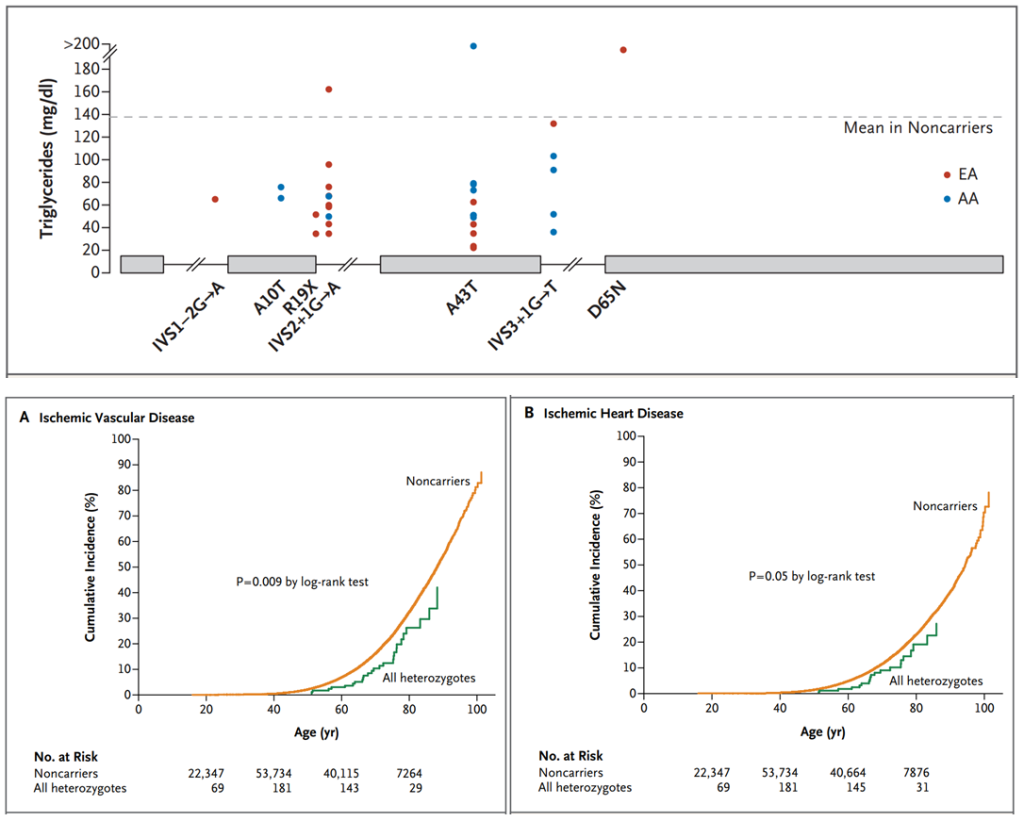
罕见的APOC3基因变异降低了血浆TG水平,并降低了血管疾病的发生风险[3、4]
基于上述遗传学发现,靶向APOC3 mRNA的反义寡核苷酸-Volanesorsen被开发用于降低肝脏ApoC-III的合成,从而降低血浆ApoC-III和甘油三酯水平。
有趣的是,在LPL功能缺失的个体中Volanesorsen仍然将血浆甘油三酯水平降低了56-86%,这提供了ApoC-III在TRL代谢中具有重要作用的概念证据,而不仅仅是通过其对LPL的调节。因此,即使在没有LPL活性的情况下,这些患者也能有效降低血浆甘油三酯水平,因为ApoC-III减少后导致了受体介导的TRL颗粒清除的增加。
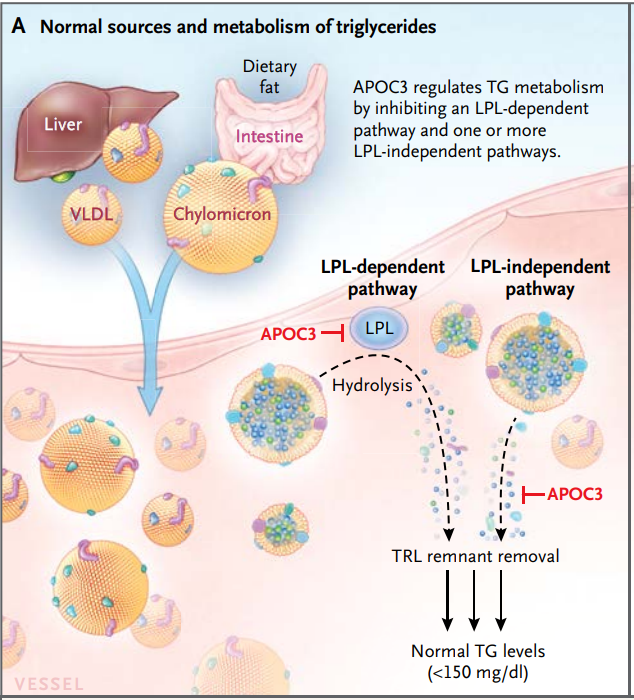
ApoC-III通过抑制LPL依赖性途径和LPL非依赖性途径调节甘油三酯代谢[5]
两项III期随机临床试验评估了Volanesorsen的疗效和耐受性,试验表明,Volanesorsen可使血浆甘油三酯水平降低70-80%,但与注射部位反应和血小板减少有关。Volanesorsen被欧洲EMA批准用于家族性乳糜微粒子综合征患者,但由于血小板减少症的脱靶效应而未被美国FDA批准。
目前,多种靶向APOC3疗法正在积极研发中,Olezarsen为靶向APOC3 mRNA的反义寡核苷酸,已在1期和2期小型试验中进行了评估,在中重度高甘油三酯血症患者中,每月一针可将甘油三酯水平降低53.1%[7];Plozasiran是一种针对APOC3 mRNA的小干扰RNA(siRNA),在重度高甘油三酯血症患者中,每季度一针可将甘油三酯水平降低57%[6]。
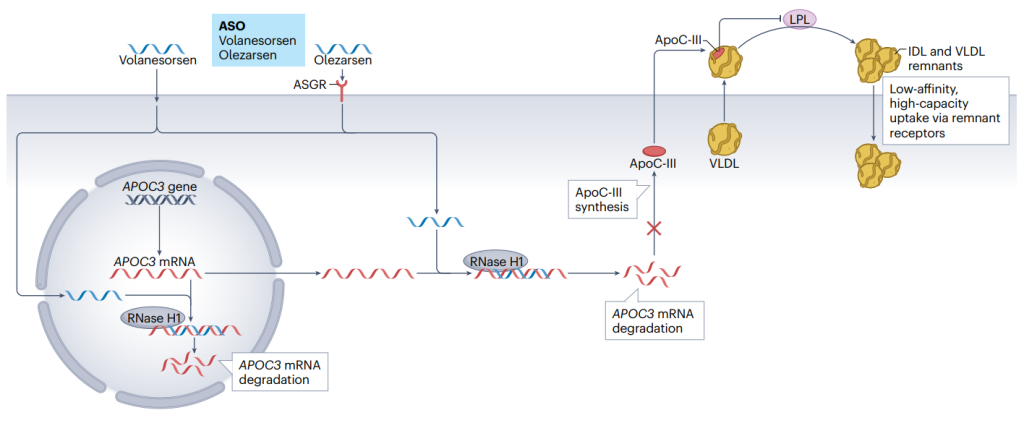
APOC3靶向疗法[7]
参考资料
1. 中国血脂管理指南(2023 年). 中国循环杂志 2023 年 3 月 第 38 卷 第 3 期(总第 297 期)
2. Mehta A, Shapiro M D. Apolipoproteins in vascular biology and atherosclerotic disease[J]. Nature Reviews Cardiology, 2022, 19(3): 168- 179.
3. Jørgensen A B, Frikke-Schmidt R, Nordestgaard B G, et al. Loss-of-function mutations in APOC3 and risk of ischemic vascular disease[J]. New England Journal of Medicine, 2014, 371(1): 32-41.
4. Loss-of-function mutations in APOC3, triglycerides, and coronary disease.
5. Bergmark B A, Marston N A, Prohaska T A, et al. Olezarsen for hypertriglyceridemia in patients at high cardiovascular risk[J]. New England Journal of Medicine, 2024, 390(19): 1770-1780.
6. Gaudet D, Pall D, Watts G F, et al. Plozasiran (ARO-APOC3) for severe hypertriglyceridemia: the SHASTA-2 randomized clinical trial[J]. JAMA cardiology, 2024.
7. Brandts J, Ray K K. Novel and future lipid-modulating therapies for the prevention of cardiovascular disease[J]. Nature Reviews Cardiology, 2023, 20(9): 600-616.
8. Ballantyne C M, Vasas S, Azizad M, et al. Plozasiran, an RNA Interference Agent Targeting APOC3, for Mixed Hyperlipidemia[J]. New England Journal of Medicine, 2024.


