脂蛋白(a)蛋白水平和遗传风险与主动脉瓣病变、后续主要心血管不良事件之间的联系
- boke
- 2025-01-10
- 4:49 下午
目的
钙化性主动脉瓣疾病(CAVD)是主动脉瓣的进行性病变,是高龄人群中常见的心脏瓣膜疾病之一。队列研究表明,CAVD与脂蛋白(a)[Lp(a)]之间存在关联。由于 Lp(a)几乎完全由遗传决定,本研究旨在确定,从遗传数据预测的Lp(a)是否与 CAVD以及主要不良心血管事件 (MACEs) 相关。

方法和结果
2012 年 1 月至 2013 年 5 月期间接受冠状动脉造影的受试者被邀请参与研究。在752名可分析的受试者中,446人进行了Lp(a)测量,703人具有可计算的 Lp(a)遗传风险评分 (GRS)。主要终点是基线CAVD和7年随访期间的 MACE。
GRS解释了Lp(a) 变异性的45%。
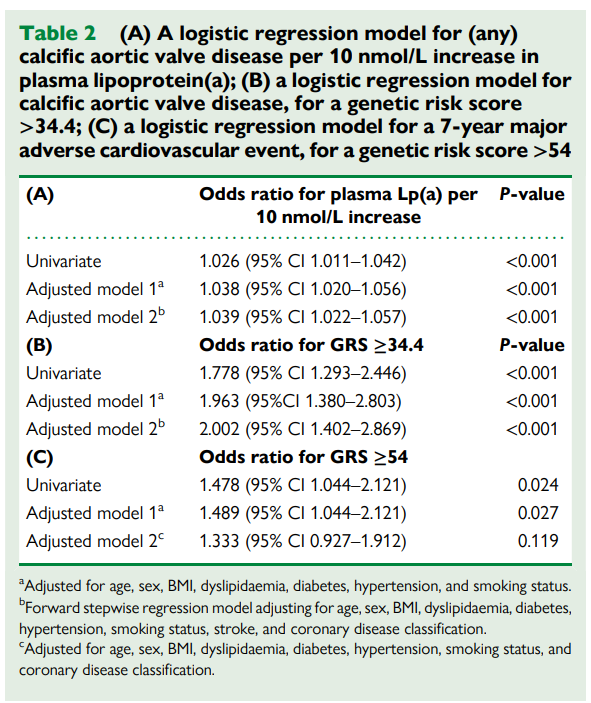
在校正了心脏危险因素和冠状动脉疾病 (CAD) 后,随着Lp(a)水平的升高,CAVD 的几率增加 [每增加 10 个单位,比值比 (OR) 为 1.039,95% CI (1.022-1.057),P < 0.001],以及 GRS (每增加 10 个单位,OR 为 1.054,95% CI (1.024-1.086);P < 0.001)。
脂蛋白 (a) 和 GRS 作为连续变量,与随后的 MACE 无关。不过,二分的GRS (>54) 与MACE相关,但当将CAD分级纳入模型后,这种关联变得不显著 (OR 1.333,95% CI 0.927–1.912;P = 0.12)。
结论
LPA GRS 可解释 Lp(a) 水平差异的 45%。Lp(a) 和 LPA GRS 均与 CAVD 的存在相关。高 GRS 似乎与未来心脏事件有关,但在二级风险人群中,如果已知 CAD情况,则似乎不提供额外的预后价值。GRS可能对评估Lp(a)与心血管及瓣膜相关结局的群体关联有用,特别是对于CAD情况不明的群体。
摘要
脂蛋白(a) [Lp(a)] 是一种几乎由一个基因决定的胆固醇类型。它与心脏病和瓣膜硬化有关。最近的进展使得通过分析一个人的DNA来预测 Lp(a) 水平成为可能。本研究分析了遗传预测的Lp(a)与不良结局之间的关联。
• 遗传预测的Lp(a)可以解释实际Lp(a)水平变异性的45%。
• 实际和遗传预测的Lp(a)都与心脏瓣膜疾病和不良心脏结局相关。如果已知心脏动脉狭窄程度,则遗传预测的Lp(a)对未来的风险预测可能帮助不大。
引言
钙化主动脉瓣疾病(CAVD)日益严重,过去十年非风湿性CAVD患者数量增加了76%。目前除了主动脉瓣置换术(AVR)外,尚无其他预防或治愈方法。年龄增长是CAVD的主要危险因素之一,大型队列研究也表明,脂蛋白(a)[Lp(a)]与CAVD的患病率和发病率均有联系。
类似地,Lp(a)与主要不良心血管事件(MACEs)相关,特别是非致命性心肌梗塞、冠心病死亡和缺血性脑卒中。欧洲动脉粥样硬化协会最近的共识声明指出,Lp(a)是CAVD的因果、持续性危险因素,并建议个人至少进行一次Lp(a)测量。
Lp(a)水平大部分由遗传决定,最近Burgess等发表的研究开发了一种遗传风险评分(GRS),利用43个SNP位点可以从遗传角度预测的Lp(a)水平的50-60%。该GRS此前已与CAVD相关联,但在其他人群中尚未得到验证。尽管人们非常关注何种Lp(a)水平所导致的风险最大,但不同Lp(a)检测方法之间差异显著,同一样本不同检测结果差异可达8%-22%。鉴于人群中Lp(a)水平差异很大,且已提出广泛筛查建议,不同检测方法的差异可能会影响风险评估的准确性。
本研究旨在调查Lp(a),无论是直接测量血浆蛋白水平还是使用遗传GRS估算,是否与新西兰临床队列中的CAVD或MACE独立相关。
方法
研究对象与研究设置
本研究数据来源于2012年1月至2013年5月在新西兰达尼丁医院连续入组接受冠状动脉造影的个体,他们参与了一项关于腹主动脉瘤患病率的研究。共有1100名患者受邀参与研究,其中48人拒绝参与或身体状况不适合参与。因此,共有1052人(参与率为95.6%)组成了主要研究队列。更多关于该队列的信息,请参阅Jones等人的论文。
本研究中,排除基线超声心动图缺失、CAVD状态缺失或AVR状态缺失的受试者,最终研究队列为757人。
变量和潜在混杂因素
研究参与者在纳入研究时填写了一份问卷,详细说明了潜在的混杂因素。研究团队在纳入研究时收集了以下变量:年龄、性别、种族、身高、体重、腰臀比、心电图显示的房颤、先前的经皮冠状动脉介入治疗、既往疾病史(自我报告、电子病历或治疗记录),包括关节炎、高脂血症、中风、糖尿病和高血压,吸烟年限、吸烟状态(当前、曾经、从未)、周围血管疾病和慢性肾脏疾病。冠状动脉造影的适应症和冠状动脉疾病(CAD)分级(使用Jones等人的标准)均来自电子病历。
钙化主动脉瓣疾病的分类
根据参与者基线超声心动图报告的临床诊断,确定是否存在钙化主动脉瓣疾病(CAVD),并将其分为患有CAVD(从轻度钙化到重度钙化)和未患CAVD两组。患有CAVD的组,根据病情严重程度,进一步分为早期(硬化、轻度、中度)和晚期(中度、重度)两个阶段。
主要不良心血管事件的定义
本研究参照美国心脏病学院/美国心脏协会临床试验心血管终点事件的关键数据要素和定义,定义MACE。它是一个复合终点,包括急性心肌梗塞、因心衰住院、因不稳定型心绞痛住院治疗以及非计划性血运重建。由于队列中不明原因死亡的情况,无法可靠地确定心血管死亡,因此未将其纳入MACE指标。如果参与者出院小结中记录了任何MACE,则记录MACE的发生日期和类型。对于急性心肌梗塞病例,还记录了类型(ST段抬高型心肌梗塞/非ST段抬高型心肌梗塞 (STEMI/NSTEMI))。
Outcome measures
主要终点为随访期间是否存在CAVD和MACE。次要终点为CAVD的分型(无、早期、晚期)以及MACE的各个构成部分。
血浆脂蛋白(a)的测量
先前已获得该队列一部分的样本(n = 433,这些受试者因心肌梗死或不稳定性心绞痛而接受血管造影检查)的血浆Lp(a)浓度(单位:nmol/L),这是作为一项研究DNA甲基化和Lp(a)关联性的研究的一部分进行的。所用检测方法为特异性酶联免疫吸附测定法,该测定法的关键在于所用抗体不结合载脂蛋白(a)的可变重复序列,因此,所得Lp(a)测量值不受载脂蛋白(a)亚型大小的影响。
Lp(a) 基因风险评分计算
Burgess 等先前建立了一个GRS模型,旨在利用LPA基因的43个单核苷酸多态性 (SNPs) 来预测Lp(a) 水平。该GRS模型用于基因估计个体Lp(a)水平。703名研究参与者拥有全基因组SNP数据,其中包含多种LPA基因的SNPs。最终,43个GRS SNPs 中,有40个可用于Lp(a) GRS 计算。GRS计算公式如下:GRS = Σ [β × SNV]
统计方法
连续数据,如果呈正态分布,则用均值 (标准差) 表示;否则用中位数 [四分位 (IQR)] 表示。如果数据连续且非正态分布,则用 Mann-Whitney U 检验;如果数据连续且正态分布,则用方差分析。分类变量用卡方检验分析。
脂蛋白 (a) 和 GRS 既作为连续变量,也作为分类变量进行分析。为了确定 Lp(a) 的高低,进行了 ROC 曲线分析,并用 Youden’s index确定了阈值。7年内主要不良心血管事件被当作二元变量处理。还绘制了分层 Kaplan-Meier 生存曲线,按 Lp(a) 或 GRS 分组。使用对数秩检验评估组差异。用向前逐步逻辑回归分析瓣膜疾病与 Lp(a)/GRS 的关联。所有数据分析都用 R 3.6.3 版本和 Survminer、tidyverse 包完成。
结果
基线特征
共有 757 人参与研究。其中,433 人有可用的 Lp(a) 测定结果,703人有可计算的 GRS。平均随访时间为 8.34 ± 0.38 年。
在 433 名具有可用 Lp(a) 测定值的参与者中,有 172 人 (38.6%) 患有 CAVD。在这些患者中,156 人为“早期”疾病,16 人为“晚期”疾病。在 703 名具有可计算 GRS 的参与者中,有 283 人 (38.9%) 患有 CAVD。其中,220 人为“早期”疾病,63 人为“晚期”疾病。
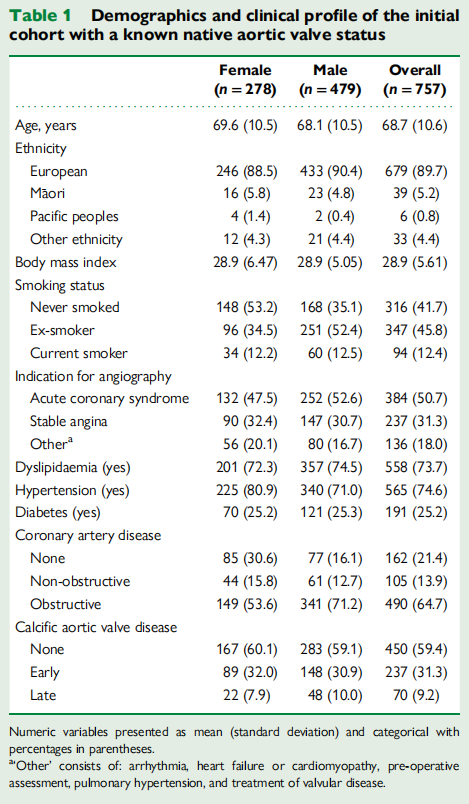
测定和遗传风险评分计算的脂蛋白(a) 的分布及其关联
血浆 Lp(a) 的分布呈正偏态,右尾较长(图 1A)。数据范围跨越近三个数量级,中位数为 62 nmol/L(IQR:24–147 nmol/L)。
在 703 名具有可计算 GRS 的参与者中,遗传预测的 Lp(a) 的分布呈双峰态(图 1B),范围较小,中位数为 16.8 nmol/L(IQR:2.47–65.90 nmol/L)。应注意,个人的 GRS 可能低于零,因为一些条件性 SNP 关联为负值。

图1 (A)测定的血浆脂蛋白(a)(nmol/L)的分布。(B)遗传风险评分的分布(遗传预测单位为nmol/L)
在同时具有 GRS 和测定 Lp(a) 的参与者中,测定的血浆 Lp(a) 和遗传预测的 Lp(a) 显著相关 [图 2A;测定 Lp(a) = (GRS × 1.52) + 47.35,P < 0.001]。GRS 似乎解释了血浆 Lp(a) 水平变化的 45%。图 2B 显示了 GRS 与测定 Lp(a) 的 Bland-Altman 图,显示偏差为 -69.9,不确定性区间为 -268.6 至 128.9,并且随着平均 Lp(a) 测量值的增加,偏差也随之增加。
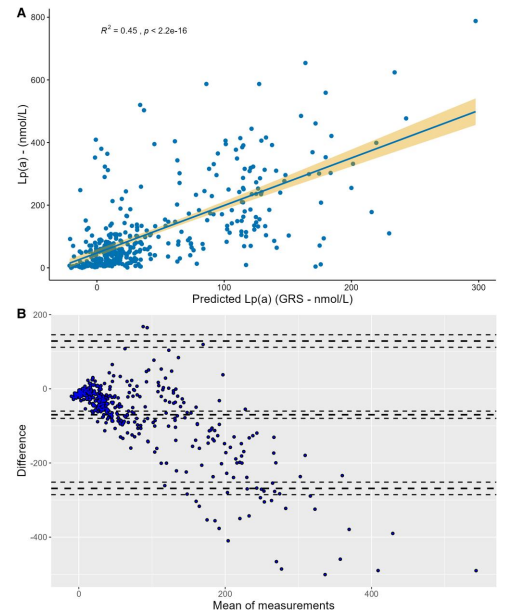
图2(A)(遗传风险评分)基因预测的脂蛋白(a)与测量的血浆脂蛋白(a).的散点图。(B)测量的血浆脂蛋白(a)与遗传风险评分的Bland-Altman图,计算出的差异以遗传风险评分减去脂蛋白(a)来衡量。
脂蛋白(a)蛋白测量值与钙化主动脉瓣疾病的关联
相对较少的人患有晚期钙化主动脉瓣疾病(CAVD),这使得在次要结局(无CAVD与早期或晚期)的不同层面上进行分析具有挑战性。血浆Lp(a)组只有16例晚期CAVD,而GRS组则有63例。因此,比较主要集中在无CAVD与有CAVD之间。
血浆Lp(a)作为连续变量,在单变量和多变量逻辑回归分析中均与CAVD显着相关。在调整后的第二个模型中,Lp(a)每增加10 nmol/L,患CAVD的几率增加1.04倍(表2A)。血浆Lp(a)百分位图(图3A)显示,在第50百分位时,患有和没有CAVD的人群水平存在差异;常用的风险临界值第75百分位对应于147 nmol/L的Lp(a)浓度。
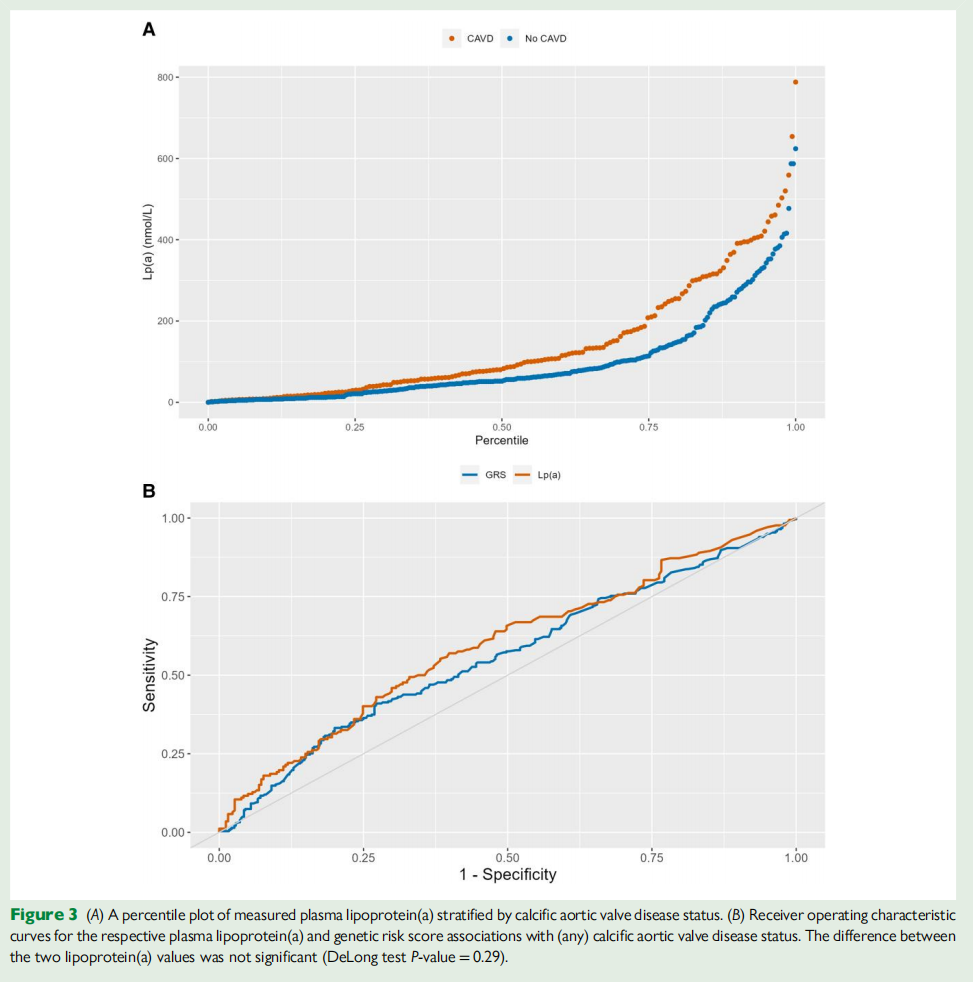
图3 (A)按钙化主动脉瓣疾病状态分层测量的血浆脂蛋白(A)的百分位图。(B)受试者各自血浆脂蛋白(a)和遗传风险评分与(任何)钙化主动脉瓣疾病状态相关的工作特征曲线。两种脂蛋白(a)值差异不显著,有统计学意义(DeLong检验P值= 0.29)
类似地,在检查GRS百分位图时,在第60百分位时存在差异;第75百分位对应于预测的Lp(a)为66 nmol/L。
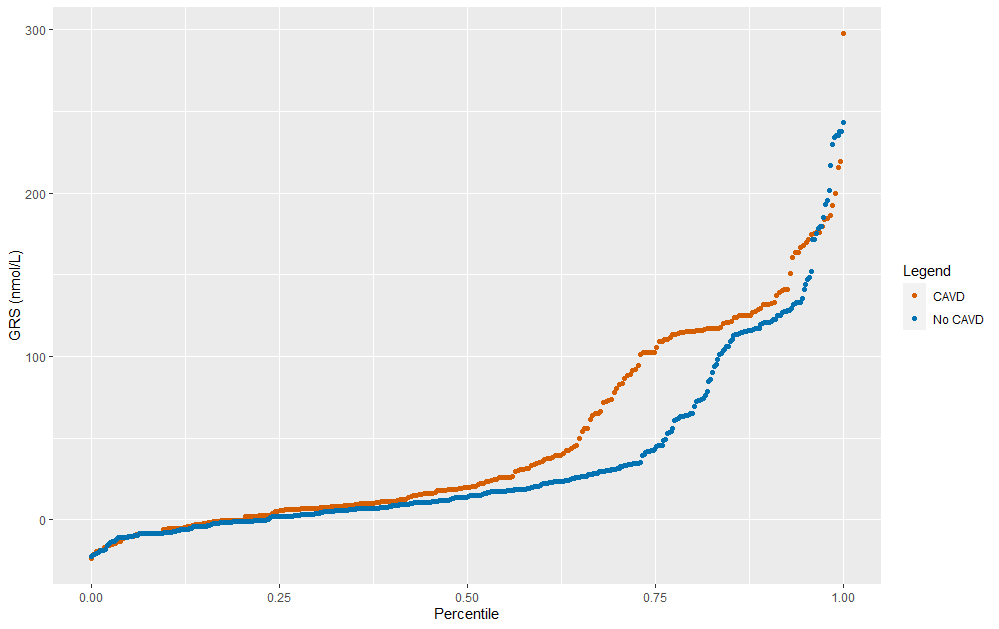
按CAVD状态分层的GRS百分位数图
血浆Lp(a)与CAVD状态的ROC曲线下面积为0.59 [95%CI 0.54–0.65,图3B]。为了进一步分析,将Lp(a)的临界值设定为69 nmol/L(基于Youden指数和ROC曲线)。在此水平下,CAVD的敏感性为0.41,特异性为0.43。先前研究也认为75百分位是高风险值,且多变量逻辑回归结果也类似。
脂蛋白(a)遗传风险评分与钙化主动脉瓣疾病的关联
血浆Lp(a)和Lp(a) GRS在预测常见CAVD方面没有显著差异(图3B)。为了完整性,我们也对GRS进行了逻辑回归分析,以CAVD作为二元结果变量。使用Youden指数法,GRS ≥34.4被确定为CAVD风险的最佳临界值(敏感性为0.28,特异性为0.59)。单变量和调整模型均显示,升高的GRS与常见CAVD几率增加相关(表2B);但这种关联不如使用血浆Lp(a)的模型强。GRS作为连续变量,在调整模型(包括年龄、性别、BMI、血脂异常、糖尿病、高血压、吸烟)中与CAVD显着相关,每增加10个单位,OR为1.054(95%CI 1.024–1.086;P < 0.001,表S5)。
脂蛋白(a)与遗传风险评分与主要不良心血管事件的相关性
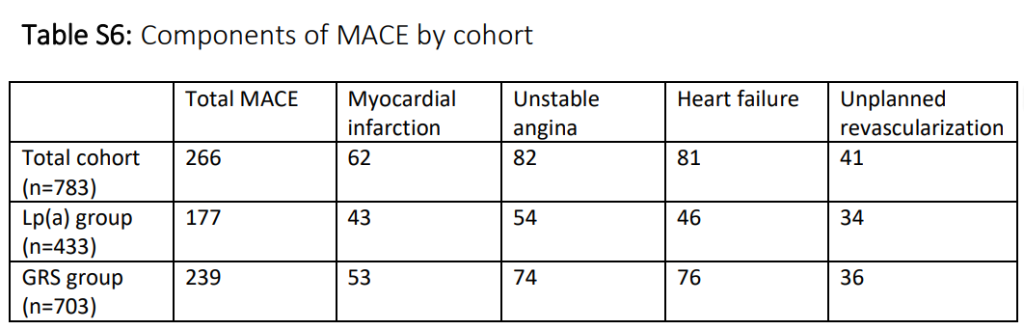
对于MACE分析,先前因缺失CAVD数据而被排除的参与者被纳入队列。随访期间,266名参与者(占34.0%),发生了MACE事件。这对应每年事件发生率为4.1%。鉴于最短随访时间为7.6年,感兴趣的结局变量是7年MACE发生。MACE事件类型细分见表S6。
通过逻辑回归分析,两者均未与7年MACE相关:血浆Lp(a) P=0.88,Lp(a) GRS P=0.35。然而,使用最佳(升高)GRS预测7年MACE发生(Youden指数临界值为54 nmol/L)提示与更短的无事件生存期存在显著关联(图4.对数秩检验P值<0.05)。
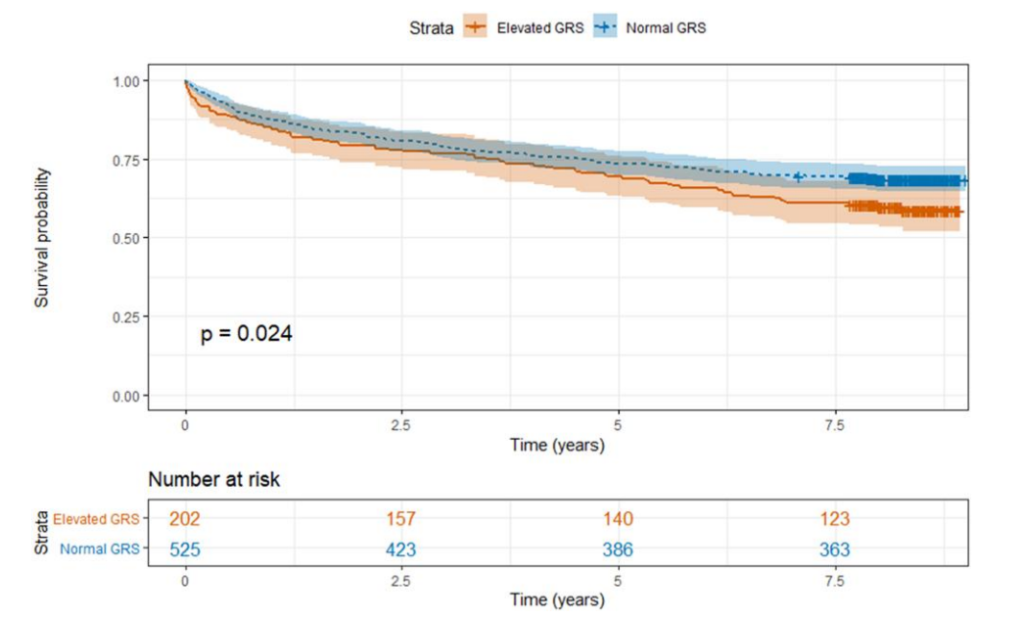
图4. Kaplan-Meier生存曲线,以主要不良心血管事件为结局,根据遗传风险评分进行分层(遗传风险评分升高,定义为≥54 nmol/L)。
对二分类的GRS进行逻辑回归分析,使用54的阈值,发现其与7年MACE存在微弱但显著的关系(表2C)。然而,如果将CAD分级纳入模型,这种关系将不再显著(Adjusted model 2C)。
单变量分析显示,血脂异常(OR 2.07,P < 0.001)、高血压(OR 1.45,P < 0.05)、吸烟史(OR 1.51,P < 0.05),糖尿病(OR 2.66,P < 0.001),BMI 每增加 1 个单位值(OR 1.03,P < 0.05)、非阻塞性冠状动脉疾病(与无冠状动脉疾病组相比,OR 2.42,P < 0.01)和阻塞性冠状动脉疾病(与对照组相比,OR 3.94,P < 0.001)均与7年MACE相关。在这项研究中,目前吸烟与7年MACE与无关联。
讨论
我们的研究旨在分析Lp(a)的直接测量和基因预测值,评估其作为新西兰队列CAVD和MACE的危险因素。血浆Lp(a)与CAVD在连续和分类变量中均显著相关[每增加10 nmol/L,OR值增加1.04 (95% CI 1.02–1.06)],这与先前文献一致。有趣的是,控制混杂因素后,这种关联更强了。
该队列几乎所有受试者都可计算出Lp(a)基因风险评分(GRS),这使得能够更好地捕捉到此类继发性高危人群的特征。比较GRS和血浆Lp(a)的ROC曲线分析显示,在预测常见CAVD方面没有显著差异,而个体预测能力相对有限。
GRS仍然相对较新,本研究是第二个验证其用于预测CAVD的研究。使用基因数据代替Lp(a)测定法有优势,因为它可以减少由于所用测定方法而不是队列特征导致的研究之间测量误差和差异。尽管我们的GRS预测“真实”Lp(a)的能力不如其他研究,但GRS捕获了45%的变异,而其他队列中为53-61%,并且在预测常见CAVD方面,Lp(a)和GRS之间没有显著差异。这表明,尽管GRS仅预测了测定Lp(a)变异的45%,但它作为Lp(a)人群分析的替代物显示出前景。
该研究还检查了血浆Lp(a)或Lp(a) GRS能否用于预测7年随访期间的MACE。血浆Lp(a)与7年新发MACE(作为二元结果)或新发MACE的时间均无关联。这与该领域其他研究的结果相冲突,我们怀疑这是由于一定程度的确定偏倚所致;因为评估的人群是心血管疾病负担相对较高的群体,Lp(a)传递的信息可能被冠状动脉评估中包含的信息所削弱。
尽管GRS的临界值54.4与7年MACE发生以及发生时间相关,但这种关联较小,一旦考虑了冠状动脉疾病状况,这种关联就变得不显著。也就是说,如果已知冠状动脉疾病状况,GRS似乎无法提供额外风险预测信息。
可以看到,由于现有的GRS预测模型只能解释Lp(a) 45%的变异,在未来,更高性能的Lp(a)GRS模型可能会提供更为清晰的视野。
参考资料
1.Moore MK, Jones GT, McCormick S, Williams MJA, Coffey S. Association between lipoprotein(a), LPA genetic risk score, aortic valve disease, and subsequent major adverse cardiovascular events. Eur J Prev Cardiol. 2024;31(10):1303-1311.


