脂蛋白清除疗法:临床应用价值、疗效及实施方案 —美国心脏协会科学声明
- boke
- 2024-10-30
- 4:41 下午
尽管有多种降脂药可供选择,但一些高危患者仍存在持续高胆固醇血症,可能需要非药物治疗。脂蛋白分离术(脂蛋白单采术,LA)是一种有价值但使用率低的辅助治疗方法,尤其对家族性高胆固醇血症的儿童和成人,能降低低密度脂蛋白胆固醇(LDL-C)和脂蛋白(a) [Lp(a)]水平。除了降低脂质,LA还能降低血清中炎症和凝血因子水平,降低血液粘度,增加微血管心肌灌注,并可能改善内皮功能。多项研究表明,LA能显著改善心脑血管结局,但在美国,其使用率远低于FDA批准的适应症范围。
高胆固醇血症是动脉粥样硬化性心血管疾病(ASCVD)发展的主要危险因素。类似于吸烟年数,动脉粥样硬化性脂蛋白升高(低密度脂蛋白胆固醇[LDL-C]、非高密度脂蛋白胆固醇[非HDL-C]、残余脂蛋白和脂蛋白(a) [Lp(a)])的持续时间和严重程度与ASCVD风险呈剂量依赖关系,有时也称为LDL年数。
这种关系在家族性高胆固醇血症(FH)患者中尤其显著,FH是一种常染色体显性遗传病,其特征是出生前即存在严重的LDL-C升高,从而显著增加ASCVD风险。尽管有多种可用的治疗方法,但FH患者通常需要进一步降低LDL-C,而脂蛋白分离术(脂蛋白单采术,LA)可能改变疾病进程。
Lp(a)是一种含有载脂蛋白B(ApoB)的动脉粥样硬化性脂蛋白,与ASCVD、动脉血栓形成和钙化主动脉瓣狭窄 (AS) 风险增加有关。全球约20%的人群,以及FH患者中比例更高的人群,Lp(a)水平升高,加剧了FH导致的ASCVD高风险。最近的孟德尔随机化分析表明,Lp(a)水平升高的患者ASCVD风险增加了约6倍。
降低Lp(a)水平的有效方法有限,除了脂蛋白分离术(LA)。缺乏明确证据证明特定Lp(a)靶向治疗对心血管有益,但间接证据表明,使用LA降低Lp(a)水平,可能与降低ASCVD风险有关。
除了治疗LDL-C和Lp(a)升高外,LA对部分难治性局灶节段性肾小球硬化症(FSGS)患者的肾脏疾病逆转有益,并且可能对妊娠高血压综合征的非适应症治疗有益。脂蛋白去除术(LA)作为一种非药物治疗方法,为这些顽固性高胆固醇血症患者带来了新的希望。
FH的治疗方法和LA的潜在适用情况
FH是全球最常见的脂质代谢遗传性疾病之一,杂合子FH(HeFH)患病率约为1/250,纯合子FH(HoFH)患病率约为1/250000,但其诊断和治疗的不足仍然显著。LDL受体(LDLR)基因功能缺失的致病性变异占FH病例的大多数。其他基因的变异也降低了LDLR介导的LDL颗粒在血液中的清除效率,包括APOB(apoB)的功能缺失变异、PCSK9的功能获得性变异以及LDLRAP1的双等位基因突变。
成人HeFH患者未经治疗的LDL-C水平通常在190~450 mg/dL之间(取决于突变严重程度和其他因素),如果不进行治疗,男性在50岁之前和女性在65岁之前发生动脉粥样硬化疾病(ASCVD)事件的风险为50%。
患有HoFH的儿童和成人患者未经治疗的LDL-C水平通常在450~1100 mg/dL之间,如果不进行治疗,则首次ASCVD事件平均发生在12岁,死亡年龄平均为18岁。
尽管HeFH患者响应标准的LDLR降脂药物治疗,通常能达到预期的LDL-C降低幅度,但HoFH患者的LDLR活性大大降低或完全缺乏,因此对提高LDLR活性降低LDL-C的标准药物反应较弱。他汀类药物由于其已证实的安全性、有效性和成本效益,是降低LDL-C的首选药物,但在HeFH患者中很少能达到LDL-C目标,在HoFH患者中则永远无法达到。
患有HeFH和HoFH,且高胆固醇血症难以控制的患者,可能是LA(一种降脂药物)的候选者,用于一级和二级预防。
LA可有效降低所有含apoB的脂蛋白,包括LDL-C和Lp(a),通常耐受性良好。LA在全球获准用于降低LDL或Lp(a),在德国、英国等国家使用频率高于美国。
在美国,LA获FDA批准用于FH患者,在生活方式干预和最大耐受剂量的LDL-C降低药物治疗后,根据不同的LDL-C阈值(图1)使用。LA是FDA唯一获准用于降低Lp(a)的疗法,但仅限于患有FH且LDL-C水平超过100 mg/dL的患者。LA还在人道主义豁免下被FDA指定用于治疗难治性原发性肾小球肾炎。尽管LA有适应症和益处,但对于高危且脂蛋白控制不佳的患者,使用率仍然偏低。

图 1. 脂蛋白分离术的关键概念概述。美国食品药品监督管理局 (FDA) 批准的适应症适用于通过生活方式干预和最大限度耐受药物治疗仍无法达到理想低密度脂蛋白胆固醇 (LDL-C) 水平的患者。患者必须满足 4 个标准中的一个(A-D 组),这些标准基于其对同型家族性高胆固醇血症 (HoFH)或杂合家族性高胆固醇血症 (HeFH) 的临床诊断、LDL-C 和Lp(a)水平偏高,以及对于确诊冠心病 (CAD)或周围动脉疾病 (PAD)的某些患者。
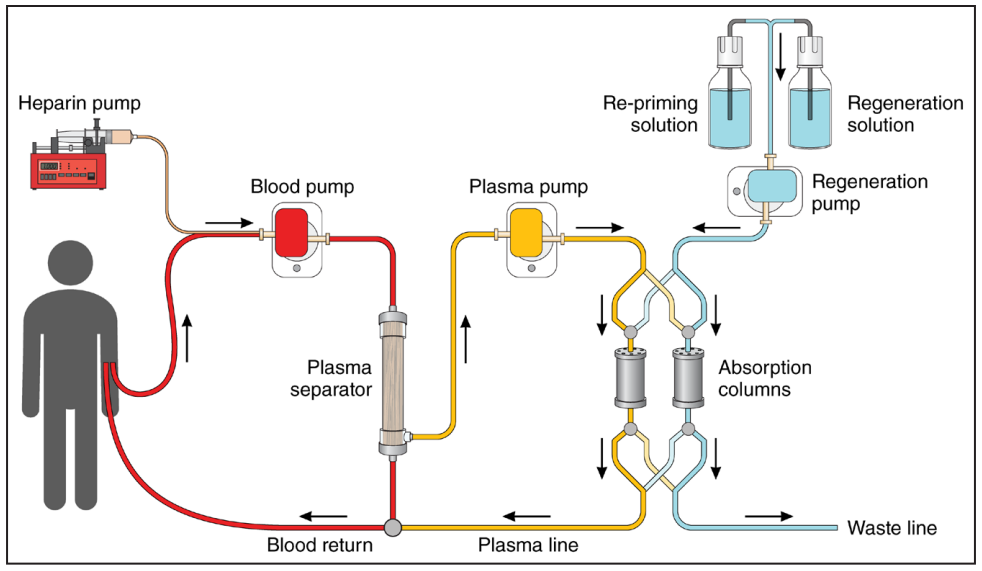
1975年,连续流动式离心血细胞分离机的发明使血浆置换术成功应用于2例高胆固醇血症患者。然而,血浆置换术如今已被低密度脂蛋白清除术 (LA) 广泛取代,后者避免了异体血制品接触以及HDL的去除。1981年,利用细胞分离器将血浆灌注通过免疫吸附柱,选择性去除LDL颗粒的技术被引入。在后续研究中,该方法被灌注抗凝血浆或全血通过亲和力柱的方法所取代,该方法包含共价连接到纤维素微球上的葡聚糖硫酸盐 (DS) 或聚丙烯酸酯包覆的聚丙烯酰胺微球,这些微球吸附LDL和Lp(a)中的载脂蛋白B,从而清除循环中的这些脂蛋白及其胆固醇(图2 和图3)。
其他LA方法包括通过向血浆中添加肝素-乙酸盐缓冲液 (或简称肝素乙酸盐缓冲液) 使LDL体外沉淀LDL,以及双滤血浆分离术。在英国,最常用的方法是DS吸附和聚丙烯酸酯/聚丙烯酰胺吸附全血中的含载脂蛋白B的脂蛋白(血浆吸附)。DS吸附血浆 (但血浆吸附除外) 和肝素诱导的体外沉淀LDL已获得FDA批准,尽管后者在美国已不再使用。

图2.葡聚糖硫酸盐纤维素珠的示意图,包括葡聚糖、低密度脂蛋白(LDL)、脂蛋白(a)[Lp[a]]、高密度脂蛋白(HDL)、极低密度脂蛋白(VLDL)、载脂蛋白A(ApoA1)和载脂蛋白B(ApoB)。
LA 疗效
FDA 批准适应症
LIPOSORBER LA-15系统适用于以下任何诊断的患者,如果饮食干预和最大剂量药物治疗无效或不能耐受:
1)LDL-C 水平 >500 mg/dL的家族性高胆固醇血症 (HoFH);
2)LDL-C 水平达到 ≥300 mg/dL 的家族性高胆固醇血症 (HeFH) 患者;
3)LDL-C 水平达到 ≥100 mg/dL,Lp(a) 水平达到 ≥60 mg/dL 且确诊为冠状动脉疾病 (CAD) 或周围动脉疾病的HeFH患者。
LA方法降低LDL-C和Lp(a)的疗效
LA后LDL-C水平的急性下降幅度取决于处理的血浆或全血量。处理约2倍的血浆或全血量可实现高达85%的急性下降。由于LA后LDL-C水平迅速反弹,该程序进行的频率越高,时间平均LDL-C水平的降低越大。
每两周进行一次,HoFH患者LDL-C降低约35%,HeFH患者约22%。每周进行一次,HoFH和HeFH患者LDL-C下降分别为46%和31%。在HoFH患者中,每周使用LA联合多种降LDL-C药物方案,可以将时间平均LDL-C浓度降低高达70%至80%,与未经治疗的基线相比(图4)。Lp(a)水平的下降趋势与LDL-C水平相似。
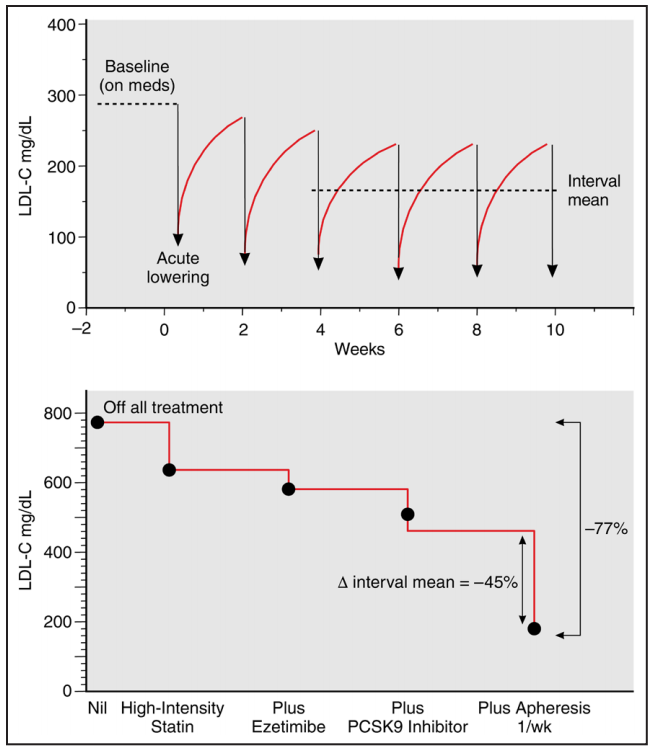
图 4. 高强度他汀类药物、依折麦布、依洛尤单抗以及每周一次脂蛋白分离术对假定家族性高胆固醇血症纯合子患者降低LDL-C水平的序贯贡献评估。上图显示了脂蛋白分离术后每次治疗之间 LDL-C 水平的平均变化情况。每两周进行一次,治疗期间平均 LDL-C 降低率约为 35%,适用于患有家族性高胆固醇血症纯合子 (HoFH) 的患者。下图显示,每周进行一次脂蛋白分离术,并结合多种药物联合降低 LDL-C 的方案,与未经治疗时的基线水平相比,HoFH 患者的时均 LDL-C 浓度降低高达70%至80%。
高密度脂蛋白胆固醇
由于其负电荷,血浆分离过程中,只有少量HDL颗粒被去除,且HDL-C水平会在1至2天内恢复到基线水平。蛋白质组学分析已鉴定了超过80种与HDL-C结合的蛋白质,例如带正电的载脂蛋白E(ApoE)、血清淀粉样蛋白A和载脂蛋白CIII(ApoCIII),这些蛋白质在很大程度上会被血浆分离去除。这三种与HDL结合的蛋白质均与心脑血管疾病风险增加有关。最近的研究发现,低HDL颗粒数量和高ApoCIII结合的HDL水平与钙化主动脉瓣狭窄风险增加有关。HDL颗粒浓度,可能比总HDL-C水平更能预测动脉粥样硬化性疾病风险,在血浆分离后会增加。响应于血浆分离的HDL成分、HDL-C和HDL-P变化的临床意义尚不清楚。
甘油三酯
血浆分离后甘油三酯的急性降低类似于胆固醇的降低,但甘油三酯会在24小时内恢复到治疗前的水平,因为极低密度脂蛋白的代谢速度远快于低密度脂蛋白(LDL)。在严重高甘油三酯血症患者中,血浆分离并非降低甘油三酯的可行选择,因为乳糜微粒会堵塞柱子,从而限制它的使用;血浆置换可以作为替代方案。然而,在高甘油三酯血症诱发的胰腺炎患者中进行血浆置换存在争议,其益处尚未得到证实。
血浆炎症标志物
血浆分离在短期和长期内均降低了血浆炎症标志物,并伴随动脉炎症标志物的降低,正如表1所示。

表1.促炎标志物:脂蛋白分离后的变化百分比。
LA和ASCVD结局
大多数关于LA的ASCVD结局数据来自前瞻性和回顾性观察性研究。缺乏LA的随机安慰剂对照ASCVD结局试验,源于需要安慰剂手术以及伦理上不允许剥夺对高危人群有益的疗法,因为该人群中可选择的疗法有限。
一些未经对照的研究表明,接受LA治疗后,事件发生率降低了50%到85%。这些显著益处可能源于脂质和非脂质因素,如先前所述。大多数这些研究将主要不良心血管事件(MACEs)作为主要评价指标,并涉及来自不同人群和地区的多个研究队列,包括德国、日本、美国和其他欧洲国家(表2)。尽管主要为观察性研究,但该证据的强度源于几个因素,包括将个体作为自身对照,ASCVD益处在多个人群和多年随访中的持续性,以及广泛的支持性机制数据。
最值得关注的心血管结局数据来自一项早期非随机平行治疗试验,该试验评估了130例患有家族性高脂蛋白血症(FH)且经血管造影确诊冠心病的日本患者的10年结局。这些患者接受了单独使用降胆固醇药物治疗(n=87)或LA联合降胆固醇药物治疗(n=43),平均治疗时间为6年。与单独使用药物治疗相比,LA联合药物治疗显着降低了LDL-C水平,从平均286.93±66.9 mg/dL降至121.04±30.94 mg/dL,降低了58%;而单独使用药物治疗则从平均233.2±51.04 mg/dL降至167.05±59.16 mg/dL,降低了28%。与单独使用药物治疗相比,联合治疗的冠状动脉事件发生率降低了72%(分别为10%对36%;P=0.0088;图5)。
2015年,Heigl等人的后续回顾性纵向队列研究,比较了118例患有心血管疾病(CVD)且LDL-C或Lp(a)水平升高的患者的4种不同类型的LA方法。在进行血浆置换治疗的平均6.8年期间,MACEs发生率比进行血浆置换治疗之前的平均6.4年期间降低了79.7%。
2022年,来自大型多中心前瞻性GLAR研究(德国脂蛋白血浆置换登记)的最新更新,由Schettler等人,在2028例LDL-C或Lp(a)水平升高或两者兼有的患者中评估了结局。将LA治疗5年期间的ASCVD事件发生率与LA治疗前1至2年期间的事件发生率进行比较,显示MACEs发生率降低了74%,主要非冠脉事件发生率降低了66%。LA对ASCVD的益处似乎在Lp(a)升高且LDL-C水平正常患者中最大,MACEs和非冠脉事件的风险降低分别为88%和73%。尽管GLAR研究使用了6种不同的LA方法,但研究结果显示,这些方法在降低MACEs或主要不良非冠脉事件方面没有显著差异。此外,尽管德国和奥地利通常每周进行一次LA治疗,而美国、英国和日本通常每两周进行一次,但ASCVD相对风险降低大致相当。
2013年,Leebmann等人在170例Lp(a)升高患者中进行了一项前瞻性多中心研究,对这些患者进行了LA治疗。LA治疗前后两年期间的年化MACE发生率降低了78%。
在2017年,Schatz等人的另一项研究显示,在113例LDL-C >100 mg/dL、Lp(a) >60 mg/dL或两者兼有的患者中,高Lp(a)水平、高Lp(a)+高LDL-C水平和高LDL-C水平的MACE发生率分别降低了77%、74%和53%。在对另一项包含133例接受他汀类药物治疗的回顾性研究的后续分析中,与南非患者相比,英国患者更有可能接受LA治疗(分别为50%和13%),获得更大的血清胆固醇降低(分别为57%和32%),并在25年的随访期间具有更低的死亡率(分别为10%和60%;P=0.02)。

表 2. 已发表的 ASCVD 结果,使用脂蛋白吸附疗法后的结果
研究局限性
现有关于LA的观察性数据存在重要局限性。研究样本量小,且未随机化。这些人群中难以控制混杂因素,可能影响结果。需要进一步研究,例如随机对照试验或更大规模的前瞻性研究,以进一步验证结果。此外,还需要更多关注患者层面研究,包括患者体验和生活质量。

图 5. 与单独药物治疗相比,低密度脂蛋白 (LDL) 滤过/清除术降低心脑血管事件发生率。在患有杂合子家族性高胆固醇血症(FH)患者中,经冠状动脉造影确诊患有先天性心脏病的患者中,接受低密度脂蛋白 (LDL) 滤过/清除术并联合降胆固醇药物治疗的组,其总冠状动脉事件发生率比仅接受药物治疗的对照组低 72%。
LA的实际应用
LA中心的可及性
虽然一些国家,比如德国,LA中心很普及,患者容量很大,但其他国家LA中心却很少或根本没有。一些美国患者可能需要跋涉300到400英里才能找到最近的LA中心。据估计,美国大约1%的FH患者可能需要LA治疗,这可能意味着11000到15000名患者需要。这比Kaneka医疗公司报告的接受LA治疗的美国患者(不到400人)多出25倍以上。这凸显了获取LA的困难,以及人们对其益处和适应症的了解不足。因此,需要增加对现有LA中心的转诊,并建立更多LA中心,让这项治疗更方便。
成本效益分析
LA的年成本因就诊设置(门诊或住院)、付款人(医保、医补或商业保险)和地区而异,在美国每两周一次的治疗,费用从每年5万美元到15万美元不等。虽然比最昂贵的依赖LDL受体降低LDL水平的疗法贵很多,但对于那些无法接受这些疗法的患者来说,LA的成本远低于其他唯一可用的治疗方法,因为两种不依赖LDL受体的降脂药Evinacumab和lomitapide,每年大约要花30万到45万美元(都作为高脂血症家族性高胆固醇血症患者的孤儿药获批)。这两类药在降低ASCVD事件方面,缺乏可靠的数据。LA是FDA批准的唯一一种治疗高Lp(a)水平,同时患有高脂血症,LDL-C超过100mg/dL,并且正在接受标准的降LDL-C治疗患者的疗法。
可以通过比较使用LA治疗的患者ASCVD结果的最全面研究,与使用依洛尤单抗(最常用的PCSK9抑制剂)的规模最大的ASCVD结果试验,来估算LA的ASCVD事件降低的成本效益。
在GLAR试验里,LA使得冠脉和非冠脉所有主要ASCVD事件的平均降低率为5.2%,而FOURIER试验中依洛尤单抗则为1.5%。因此,LA可能比依洛那单抗的ASCVD风险降低率高出3.8倍左右。
假设LA的年折现成本为5万美元,而依洛那单抗的年折现成本为6634美元(全国连锁药店最低现金价),LA的成本大约是依洛那单抗的7.6倍。由于额外成本的7.6倍大致是ASCVD风险降低的3.8倍的两倍左右,因此可以合理地估计,LA的成本效益大致是依洛尤单抗每调整后生命年成本的两倍左右。这大约是每调整后生命年10万美元(依洛尤单抗为5万美元),这在美国家庭标准中被广泛接受为保守的支付意愿阈值。
患者依从性
LA治疗的挑战包括每两周一次的治疗频率、影响工作能力的治疗、费用、侵入性、保险可及性担忧以及由于治疗设施有限导致的治疗可及性问题。在美国,只有50个州中的33个州有LA降低疗法治疗设施,这给一些患者带来了较长的治疗路程。
结 论
一次疗程的LA可使Lp(a)和LDL-C水平降低65%至85%;降低炎症指标、促凝因素、HDL成分、血液粘度和内皮功能障碍;并改善微血管心肌血流灌注,这表明LA可能通过多种途径降低心血管疾病风险。证明LA具有心血管益处的证据主要来自前瞻性和回顾性研究,包括减少心绞痛、增加步行距离,以及斑块稳定和消退,还有黄瘤消退。尽管需要更明确的研究,但现有数据表明LA可能与MACEs发生率显着降低63%至95%相关。
尽管目前LA在美国的使用有限,同时受到LA设备可及性、成本效益和生活质量的影响,但它对于顽固性高血脂患者的临床益处明显,因此,应在充分沟通LA的风险与获益的前提下,充分利用LA。
参考资料
1.Lipoprotein Apheresis: Utility, Outcomes, and Implementation in Clinical Practice: A Scientiffc Statement From the American Heart Association . Arterioscler Thromb Vasc Biol. 2024;44:e00–e00.
推荐阅读
这是示例文本,单击 “编辑” 按钮更改此文本。


