基于中国大规模前瞻性队列人群的心脑血管疾病基因组研究与成果转化
- boke
- 2022-10-31
- 7:07 上午
心血管疾病是中国和世界范围内导致死亡和疾病负担的主要原因,根据《中国心血管健康与疾病报告2020》报道,我国心脑血管疾病患者数量达到3.3亿,脑卒中1300万,冠心病1139万,其中每年有450多万人因心脑血管病失去生命,脑卒中和冠心病也是致死率最高的单病种疾病,心脑血管疾病给社会和个人都带来了沉重的负担[1]。
人类基因组计划为(Human Genome Project,HGP)我们解码生命和实现疾病精准防控带来了机遇。随着人类基因组计划、人类单体型图谱计划以及千人基因组研究计划的完成,标志着人类正式从分子水平启动了生命解码的新征程。
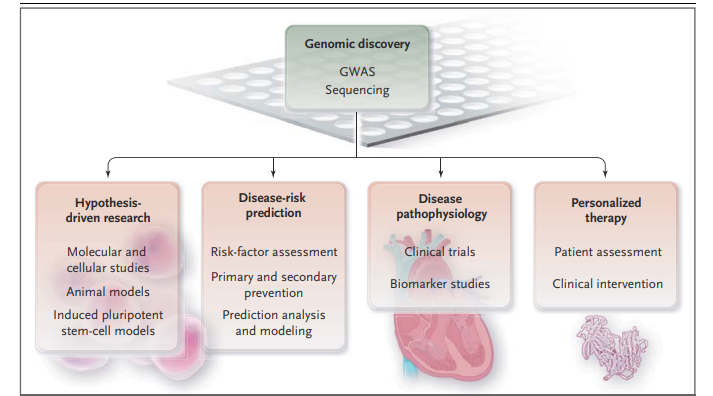
图1 从基因研究到临床应用[2]
心血管疾病由基因和环境因素的复杂关系引起的,基因组学研究正在深刻影响着心血管疾病的诊断、风险分层与治疗,主要包括多基因风险评分(PRS)预测心血管疾病发病风险,单基因遗传性心血管疾病的基因诊断以及药物基因组学检测预测药物反应三个方面[3]。
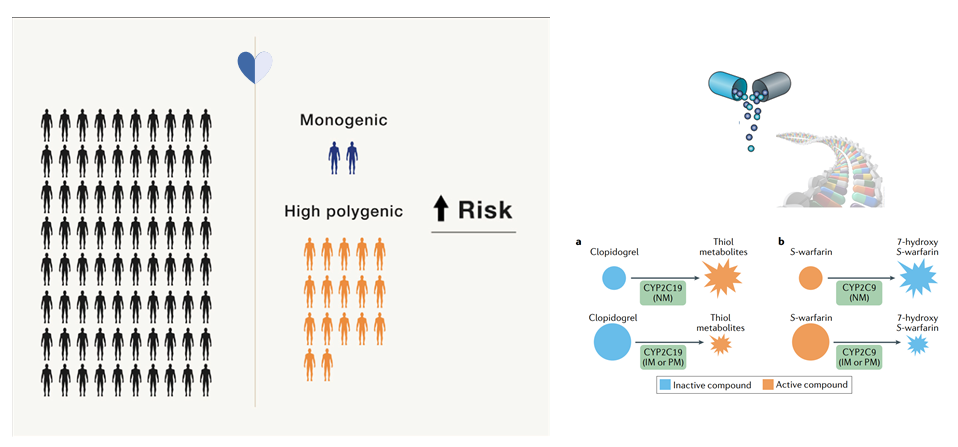
图2 多基因风险评分(PRS)、单基因遗传性心血管疾病和药物基因组学应用于心脑血管诊治[4-6]
在中国,国家心血管病中心的科研与临床团队已经完成了中国人群大规模基因组学研究,顾东风院士与鲁向锋教授的研究团队协调组织中国大陆、中国香港、中国台湾、新加坡、马来西亚、日本、菲律宾等东亚人群以及欧美人群,涉及到全球100余个队列,开展了50万人群心血管疾病基因组学研究,系统地解码了影响中国人群冠心病、血脂遗传和高血压等心血管疾病遗传信息,相关研究成果发表《Nature Genetics》、《European Heart Journal》等世界顶尖的学术刊物。这些研究结果不仅全面鉴定中国人群心血管疾病遗传特征谱,而且揭示了中国人群特异性遗传标记,并获得10余项发明专利授权。通过寻找影响疾病发生易感基因和遗传标识,有助于疾病的病因解析、预测预警和精准预防。

图3 中国人群大规模基因组学研究
国家心血管病中心研究团队在过去20余年建立了全国18省市12万以上队列人群,并长期随访冠心病和脑卒中的发病情况,通过检测冠心病、脑卒中、血脂、血压、血糖、肥胖等600余个遗传变异,统筹计算得出综合风险评估模型(metaPRS)。该风险评分模型是综合考虑个体的遗传风险和临床风险建立的预测模型,能够有效预测冠心病和脑卒中发病风险,并描绘个体随年龄增长的发病轨迹;通过该模型能够更加准确的预测个体未来10年并且到80岁的心血管疾病风险。[查看链接:中国人群队列心脑血管疾病研究与成果转化(metaPRS的技术应用)]。
脑卒中metaPRS研究表明,高遗传风险者发生脑卒中的风险是低遗传风险者的两倍(终生发病风险25.2%/13.6%),如果高遗传风险者同时伴有脑卒中家族史、高血压或糖尿病,其终生发病风险将分别达到41.1%、33.2%或42.5%。此外,该研究还发现,高遗传风险者可以通过控制血压等重要临床风险因素来降低脑卒中的发病风险(图4),例如,如果高遗传风险者能将血压控制在收缩压小于120mmHg、舒张压小于80mmHg的范围内,其脑卒中终生发病风险将降低至14.9%,接近低遗传风险者的水平[7]。
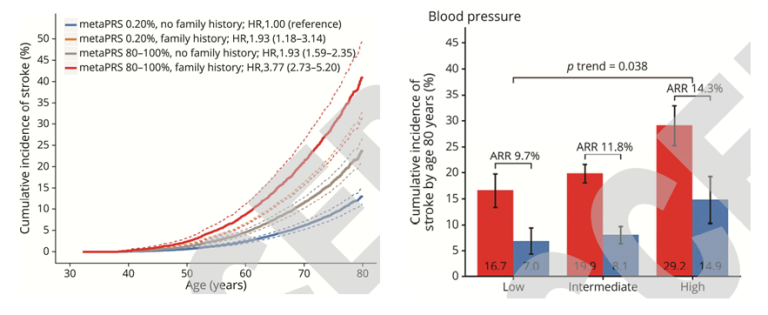
图4 家族史风险因素增加高遗传风险者脑卒中终生发病风险(左),控制血压可有效较低高遗传风险者的终生发病风险(右)[7]
中国科研团队关于冠心病metaPRS的相关研究得到了国际专家高度认可,2022年3月《欧洲心脏杂志》进行了重点述评[16],尤其是对于该模型工具在预防和临床实践中的应用价值做出了积极的肯定。述评认为,该研究首次探索了metaPRS在中国人群冠心病一级预防中的临床价值,对于冠心病中等临床风险的人群,metaPRS能够进一步发现高风险人群,实现更精准的疾病风险预测(图5)。该研究采用的临床风险与多基因风险联合评估模型进一步提升了冠心病风险预测的准确性,展现了在临床实践中对识别的高风险个体进行个性化干预的巨大潜力[8]。
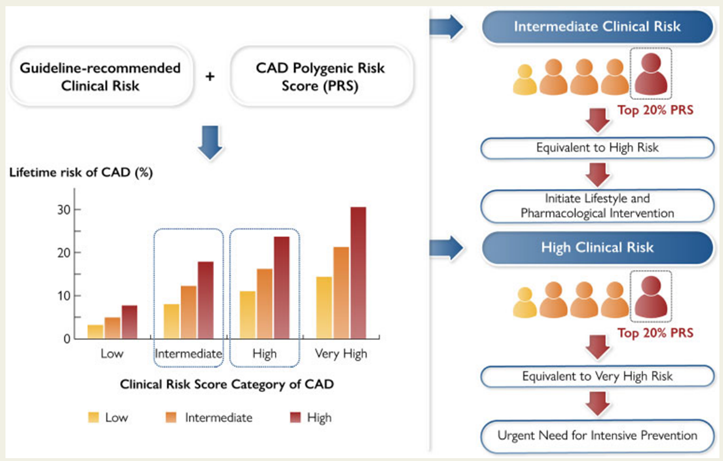
图5 通过综合型冠心病metaPRS模型精准筛选出需要开展针对性干预人群[8]
单基因遗传性心血管疾病是指由单基因突变导致并符合孟德尔遗传规律的心血管疾病,相比于其他由生活环境、日常习惯等外部因素导致的心血管病,该类疾病主要是因患者特定基因上的致病变异导致相应蛋白结构及功能异常而引起的。[查看链接:单基因遗传性心血管疾病的检测]
单基因遗传性心血管患者比例较低,但由于其发病年龄早(青年时期,甚至幼年期发病),症状更严重,预后更差,具有明显的家族史;加之我国发病人群总数庞大,保守估计,我国猝死高危的单基因心血管病患者至少500万。例如,家族性高胆固醇血症(familial hypercholesterolemia,FH)是常见的常染色体单基因遗传性疾病,HeFH患病率为1/(16-30)万,HoFH患病率为1/(200-244)万;肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种以心肌肥厚为特征的心肌疾病,主要表现为左心室壁增厚,患病率为约1/500,致病基因的外显率(即携带致病基因患者最终发生HCM的比率)为40%~100%,发病年龄异质性也较大;中国HCM患病率为80/10万,粗略估算中国成人HCM患者超过100万。因此,基因检测在该类疾病的筛查、诊断、危险评估防治方面的作用日益重要[9]。
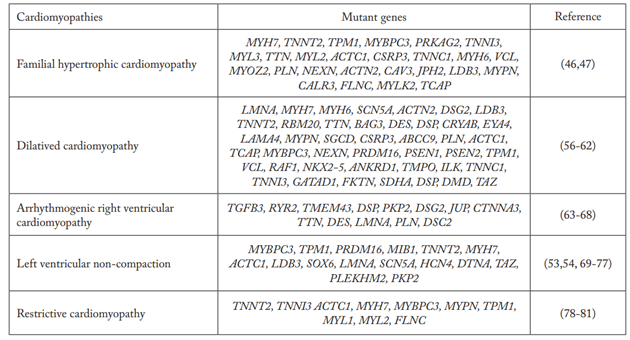
表1 遗传性心肌病相关基因[10]
心血管疾病的治疗正在进入个体化医疗的时代。药物基因组学作为个体化医疗的一种工具,它的主要目标是根据个体患者的基因组决定最优的药物治疗。而且通过研究药物基因组学也可增强我们对心血管病机制的理解,揭示新的药物靶点和确定药物耐药性的机制,例如不同的基因多态性型是如何影响一些不同抗心血管疾病药物的临床效用,包括他汀类药物、氯吡格雷、阿司匹林和华法林等。
药物基因组学的主要目的是通过根据基因数据找到药物靶点转化为针对患者的个体化治疗,从而改善临床结果。药物基因组学帮助确定了预后生物标志物并设计更好的靶向治疗,还有更多的药物使用受益于药物基因组学方法,甚至更多的受益将会从被研究的大量基因中获得[11]。

图6 基因多态性影响抗心血管药物反应[11]
荧光定量PCR(qPCR)、基因芯片(Microarray / DNA-Chip)、一代测序技术(Sanger测序)、二代测序(NGS,Next-Generation Sequencing)等技术都是重要的基因检测方法。但不论是PRS、单基因遗传性心血管疾病还是心血管疾病药物基因研究,都需要对数量庞大的基因组区域进行快速有效的检测。
基因芯片的技术原理是事先将探针固定在物体表面,同时利用碱基互补配对原则和荧光标记法,将基因探针与被标记的核酸片段进行杂交,通过检测荧光信号测定靶基因的具体信息。基因芯片在SNP鉴定、基因表达检测和甲基化研究中仍有较为广泛的应用[12]。基因芯片虽然可以一次同时检测大量位点的变异信息,但也存在着一些局限性,其本质在于基因芯片无法获得序列信息,其基于对变异位点、变异信息及其附近序列的充分掌握并设计针对性探针,只能获得固定位点的部分变异信息,不具备“发现”能力,因此,较为常见的是SNP芯片;此外,随着疾病相关的基因变异数据库不断更新,其开发、产品迭代成本较高,较难满足日益增长的基因组学研究。
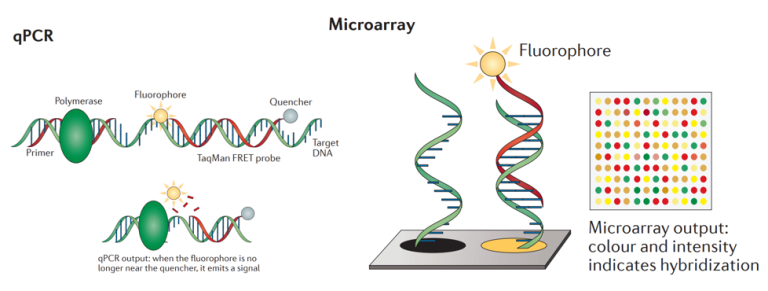
图7 qPCR与基因芯片技术原理示意图[12]
现在,NGS高通量测序技术已经成为基因组研究的重要方法,NGS可以一次性获得多达千万条的片段序列信息,能够全面检测基因组的SNV、InDel、CNV等不同变异信息,再结合液相基因芯片技术开展目标区域靶向测序(包括全外显子测序WES),可以使得检测更加准确、经济和高效。
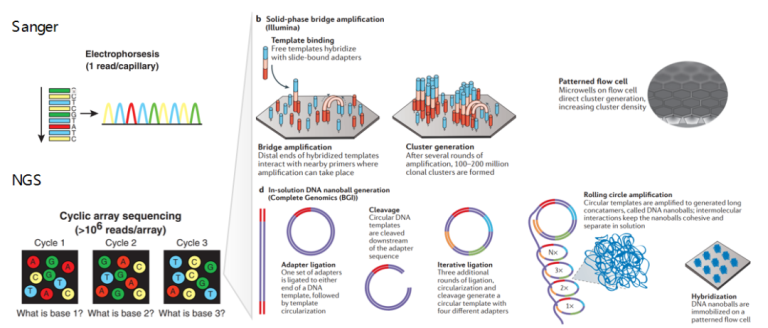
图8 一代测序以及二代测序技术原理示意图[12、13]
液相与固相基因芯片靶向测序技术相对应,其差别在于前者的探针是溶于液体中;相比固相基因芯片靶向测序,液相基因芯片技术的样本投入量要求更低(ng级别),在实际应用中具有更好的适应性和兼容性,比如FFPE样本,和血浆cfDNA样本;其流程开展不依赖特定设备,更加简便。液相基因芯片靶向测序技术可用于DNA、RNA和表观组学研究,其检测灵敏度高、稳定可靠,因此,近80%肿瘤多基因伴随诊断的IVD产品均基于液相基因芯片靶向测序技术开发。
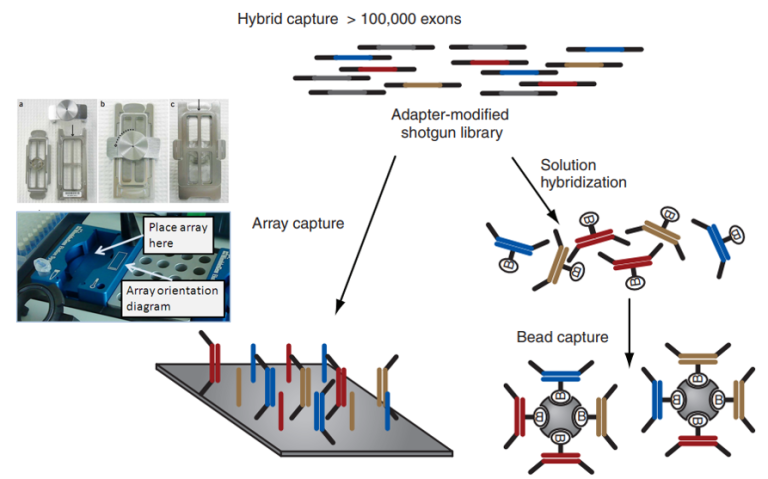
图9 固相与液相基因芯片靶向测序技术原理示意图[14、15]
伯科生物科技公司自主完整的开发了液相基因芯片靶向捕获技术(TargetCap®)的5个模块,共有15种配套试剂,包括,Gene Panel(生物素探针)、封闭试剂(Blocking Reagents)、杂交缓冲液(Hybrid Buffer)、捕获磁珠(Capture Beads,Streptavadin Beads)和富集试剂(Enrichment Reagents);目前,伯科TargetCap®技术已经实现全面国产化,适合多组学研究,兼容Illumina和MGI等NGS测序平台,同时适配三代(长读长)测序平台。现在,伯科团队已经完成了国家心血管疾病重点科技成果的产品转化,开发了心脑血管健康评估基因芯片,通过外周血或唾液的检测就可以及早了解冠心病、脑卒中等心血管疾病的风险,进而尽早开展防治措施或健康管理。同时,开发了该检测的自动化报告系统,包括完整的生物信息分析软件,变异过滤数据库、变异解读数据库、药物信息数据库、临床有效性数据库。





