潜能不明克隆性造血(CHIP)近期进展:肺部疾病
- boke
- 2025-05-23
- 10:34 上午
潜能不明克隆性造血(CHIP)
2022年,世界卫生组织(WHO)和国际共识分类指南将CHIP定义为:在未被诊断为血液疾病或不明原因血细胞减少症的个体中,存在已知驱动血液恶性肿瘤基因的获得性体细胞突变,其变异等位基因频率(VAF)在血液或骨髓中至少为2% [1,2]。
先进的分子生物学技术,特别是高通量测序,显著提升了我们对CHIP的理解。曾经被认为是罕见现象,如今已认识到它是一种常见的生物学现象,与各种疾病的发生、发展和预后密切相关。
CHIP是一种常见的与年龄相关的生物学状态,且克隆性造血的发生率随着年龄增长而上升。然而,越来越多的研究将CHIP的应用范围扩大到心血管、肾脏、肝脏和肺部等非血液疾病。此外,随着基因检测技术和预防医学的快速进步,CHIP在各种疾病中的作用有望成为预防疾病发生和发展的重要靶点。

图1. CHIP的作用不仅限于血液领域,流行病学研究支持CHIP与心血管疾病和非心血管疾病相关,包括阿尔茨海默病、骨质疏松症、血管炎、关节炎、牙周病、肾病、2型糖尿病、慢性肝病、慢性阻塞性肺病和肺癌[3]。
CHIP与肺部疾病
CHIP最近已被证明是先天免疫系统受损导致的细菌性肺炎的危险因素。一项在英国生物样本库进行的研究表明,与其他疾病相比,CHIP携带者更容易患肺炎[4、5]。在研究中,Quin等探讨了CHIP在细菌性肺炎中的作用。
使用英国生物库数据(438,421人),发现CHIP与肺炎发生之间存在正相关关系。炎症增加了肺炎风险,而具有缺陷性IL6受体多态性的CHIP携带者则受到保护。为了更好地描述易感性途径,通过表征来自人类捐赠者和缺乏Tet2小鼠的免疫细胞,作者从机制上将髓样免疫细胞功能障碍与CHIP介导的细菌性肺炎风险联系起来。
与人类CHIP携带者一样,Tet2-/–小鼠具有造血异常,导致外周血中炎性单核细胞和中性粒细胞的扩增。然而,这些细胞在防御肺炎链球菌方面不足,导致Tet2-/-小鼠病理增加、细菌清除受损和更高的死亡率。在转录方面,虽然Tet2-/-中性粒细胞的炎症相关通路被上调,但迁移和运动通路被破坏。使用活体成像技术,证实了Tet2-/-中性粒细胞在运动、病原体摄取和中性粒外陷阱(NET)形成方面的损害。综上所述,研究表明CHIP是与先天免疫缺陷相关的细菌性肺炎的危险因素,提供了老年人的Tet2状态作为潜在的预后工具,以指导与免疫调节相关的治疗选择。
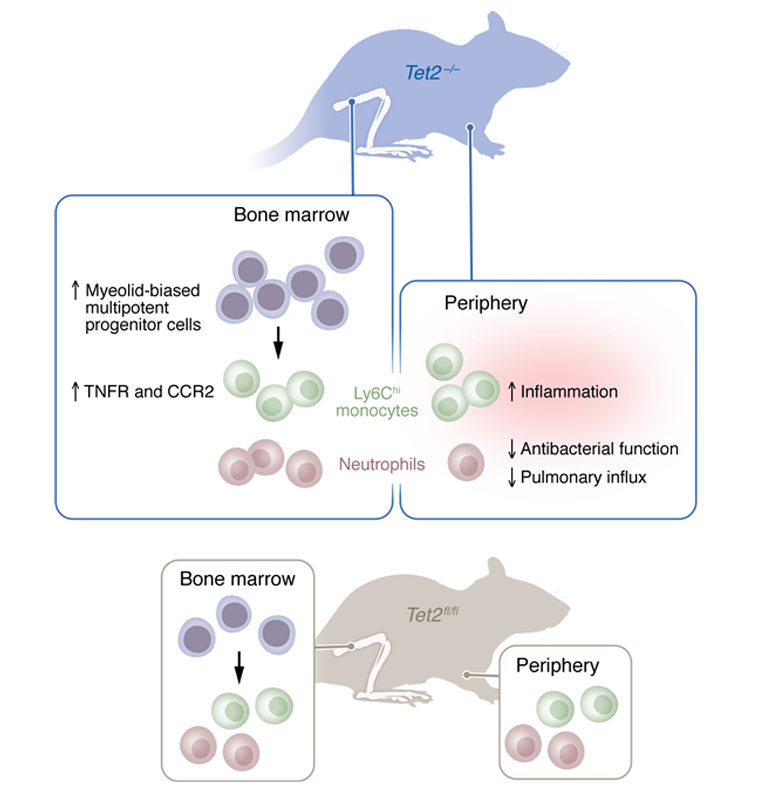
图2. CHIP驱动免疫细胞的变化[6]。与Tet2fl/fl小鼠相比,Tet2敲除小鼠(Tet2–/–)显示出骨髓中髓样祖细胞的增加,炎症性单核细胞反应的增加,以及外周中性粒细胞抗菌活性的降低。
CHIP与心血管疾病和血栓形成相关的证据表明,CHIP通过中性粒细胞活化和中性粒细胞胞外陷阱形成导致易形成血栓的状态[6, 7]。
慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)是一类以慢性血栓阻塞肺动脉管腔、继发肺血管重塑为主要病理特征的疾病,慢性血栓阻塞与肺血管重塑可引起肺动脉管腔狭窄和(或)闭塞,并由此导致肺血管阻力和肺动脉压力进行性升高、右心功能不全。
CTEPH的病因在很大程度上仍不清楚。克隆性造血(CH)已被报道与心血管疾病和血栓栓塞性疾病相关。因此,研究人员调查了CH在CTEPH患者中的患病率和临床影响[7]。
对214例CTEPH患者进行了全外显子组测序(WES)和直接深度测序,比较了CH携带和非携带患者在治疗前后的临床数据,并通过RNA测序和血清分析来探讨CH对CTEPH的发病机制。
在纳入的患者中,20.1%的患者存在CH相关基因的变异,特别是在80至89岁的患者中,这一比例达到44.4%。在临床影响方面,与非CH携带者相比,CH携带者B型钠尿肽水平和家庭氧疗率显著提高,6分钟步行距离显著缩短。此外,尽管使用了抗凝剂和额外的血管成形术,但在携带CH的患者中,新的血栓形成和血管成形术事件在治疗完成后更为频繁。
RNA测序分析显示,血液凝固和中性粒细胞细胞外陷阱形成途径在CH患者中富集。此外,血清瓜氨酸化组蛋白H3水平在CH患者中高于未患CH的患者。
该研究的结果提出了一种可能性,即CH可能通过激活中性粒细胞和形成中性粒细胞细胞外陷阱来诱导一种更促血栓形成的状态,从而促进CTEPH患者的发病机制和治疗反应不佳。
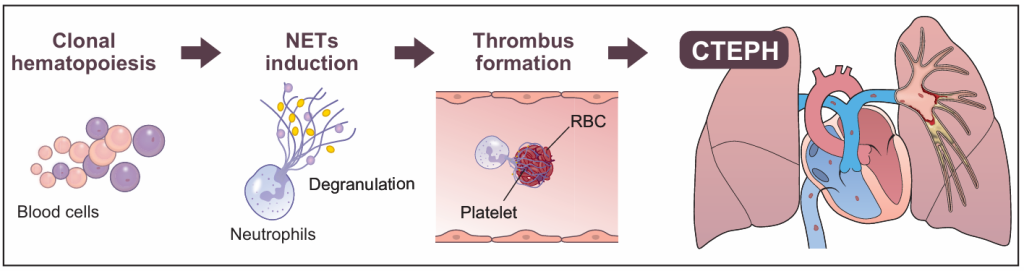
图3. CH导致CTEPH的潜在机制[6]。本研究结果表明,CH可能通过中性粒细胞激活和NET形成途径诱导促进血栓形成,当这些血栓被冲刷并附着于肺动脉时,CTEPH的发病机制就产生了。NET,中性粒细胞胞外陷阱;RBC,红细胞。
此外,另一项研究首次表明,在9.4%的CTEPH患者中发生的CHIP突变与严重的炎症状态有关,并在长期随访中预后较差[7]。
通过对2006年10月至2021年12月期间3个中心转诊的499名CTEPH患者的NGS WES测序数据进行逐步测序,确定了CHIP突变。将CHIP与CTEPH患者的全因死亡率相关联。为了深入了解潜在机制,还确定了CHIP与炎症标志物之间的关联。
总共有47名(9.4%)CTEPH患者携带至少1个CHIP突变,变异等位基因频率≥2%。最常见的突变发生在DNMT3A、TET2、RUNX1和ASXL1。在随访期间(平均55个月),CHIP组有22名(46.8%)患者死亡,非CHIP组有104名(23.0%)患者死亡。在完全校正的模型中,CHIP与死亡率的关联仍然显著(HR,2.190)。此外,携带CHIP突变的患者循环白细胞介素-1β和白细胞介素-6水平较高,白细胞介素-4和IgG半乳糖基化水平较低
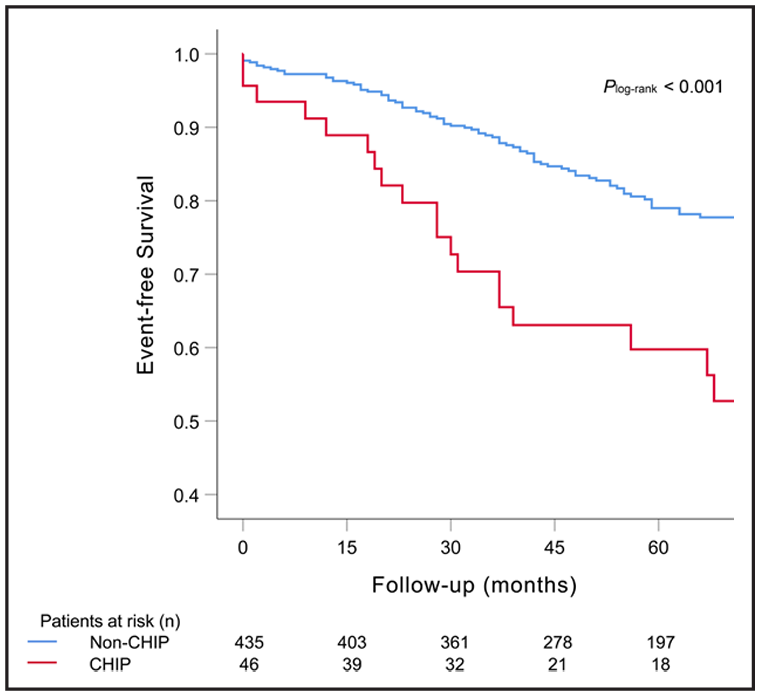
图4. 按慢性血栓栓塞性肺动脉高压患者的CHIP状态分层的全因死亡Kaplan-Meier生存曲线[7]
此外,CHIP也与慢性阻塞性肺疾病[8]和肺癌[9]相关。
慢性阻塞性肺疾病(简称慢阻肺,COPD)是一种异质性肺部病变,其特征是慢性呼吸系统症状(呼吸困难、咳嗽、咳痰),原因与气道异常(支气管炎、细支气管炎)和(或)肺泡异常(肺气肿)相关,通常表现为持续性、进行性加重的气流阻塞。慢阻肺是我国最常见的慢性呼吸系统疾病,患病率高,疾病负担重。
关于慢性阻塞性肺疾病(COPD)患者CHIP的临床结果数据有限。最近有研究评估CHIP作为COPD生物标志物的临床意义[8]。本回顾性研究对2013年1月至2019年12月间在首尔国立大学医院气道登记处前瞻性登记的慢性阻塞性肺疾病患者进行了研究,并进行了肺功能和血液测试。根据吸烟状态和气流阻塞的严重程度来评估CHIP评分。
分析了125例COPD患者的NGS靶向测序数据(关注25个免疫相关CHIP基因),以检测CHIP。当前吸烟者在结合DNMT3A、TET2和PPM1D(DTP)、DNMT3A和PPM1D基因的情况下,比从未吸烟或前吸烟者有更高的CHIP患病率。DTP和DNMT3A基因的CHIP与当前吸烟者显著相关([aOR],2.80;aOR,4.03)。中度至重度气流阻塞患者在大多数被探索基因中的CHIP患病率高于轻度阻塞患者,尽管差异无统计学意义。ASXL1基因的CHIP与轻度、重度和全急性加重病史显著相关。鉴于特定基因中的CHIP与戒烟状态和急性加重显著相关,CHIP可以被认为是COPD患者的候选生物标志物。
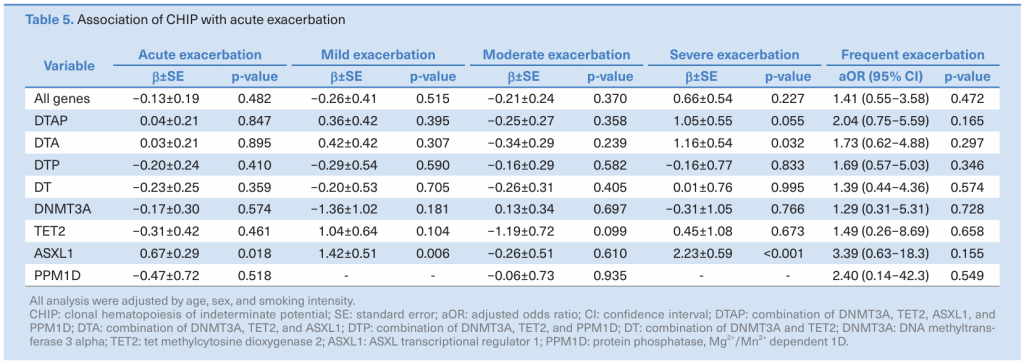
图5. CHIP与急性加重慢阻肺的关联[8]。
为了前瞻性地研究克隆性造血(CH)与肺癌发病的相关性。在200,629名进行WES测序的英国生物样本库(UKBB)参与者(832例病例/3951例对照)以及Mass General Brigham生物样本库(MGBB,2010-2021)进行WES测序的27,975名参与者中(141例病例/652例对照)进行嵌套病例对照研究。同时,还比较了5,003例实体瘤患者(2,279例肺癌)的CH频率[9]。
在UKBB 中,CH的存在与肺癌风险增加相关(OR,1.36)。在排除了慢性阻塞性肺疾病的参与者后,相关性仍然强劲。未发现与已知风险因素(包括多基因风险评分和C反应蛋白)有显著的相互作用。在MGBB中,我们观察到类似的现象。对UKBB和MGBB的荟萃分析CH总体OR为1.35,对于变异等位基因频率≥10%的OR为1.61。此外,与其他肿瘤相比,等位基因频率为10%的CH在肺癌中富集(肺癌对乳腺癌的OR值:1.61)。上述研究表明,与已知的危险因素无关,CH与肺癌风险增加有关。
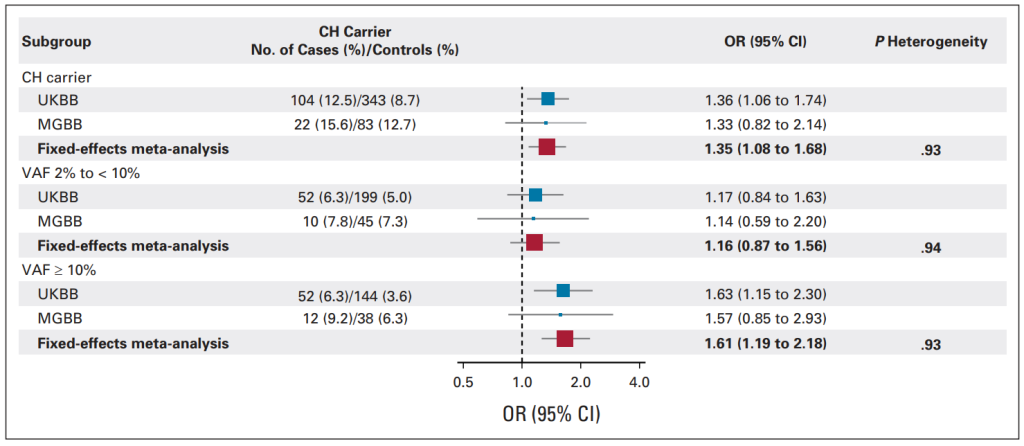
图6. 对CH与新发肺癌风险之间关联的荟萃分析(UKBB和MGBB数据库)[9]。
伯科全外芯片 – Core Exome Panel v3.0
TargetCap@ Core Exome Panel v3.0基于伯科高品质DNA探针合成技术开发,全流程国产制造,由~40万条探针组成,以GRCh38/hg38人类参考基因组设计,参考Refseq、CCDS、ClinVar等数据库,覆盖19,524个基因,目标区域为33.9Mb。
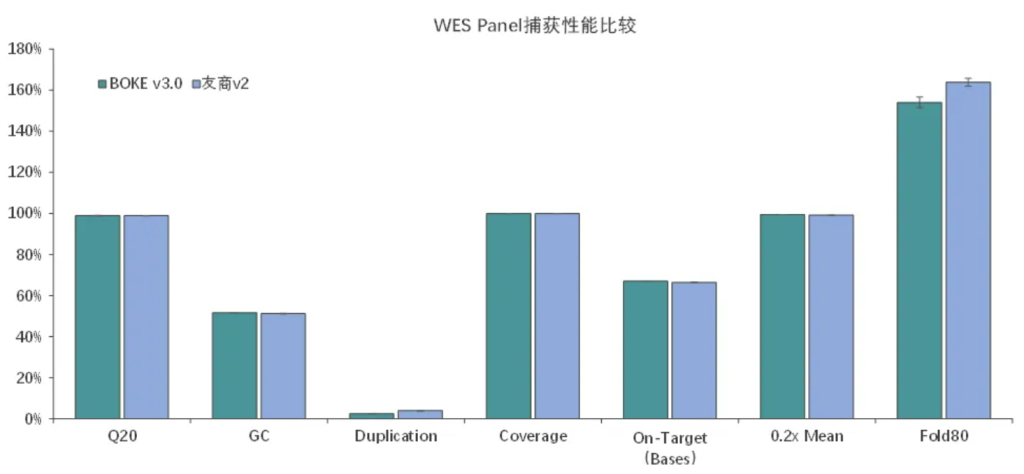
捕获性能比较
伯科全外芯片v3.0性能优异与国外友商同类型产品v2相当,中靶率、覆盖率、覆盖均一性等参数均达到国际领先水平。
适配高通量流程平台
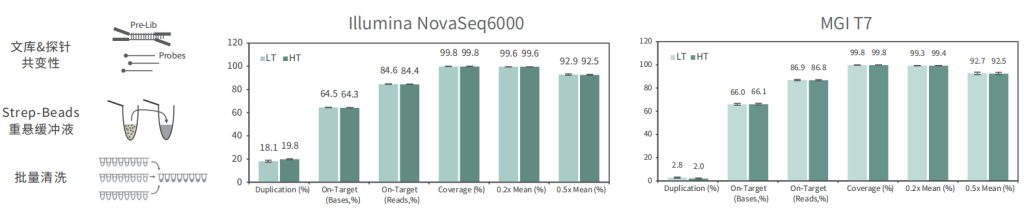
批次稳定
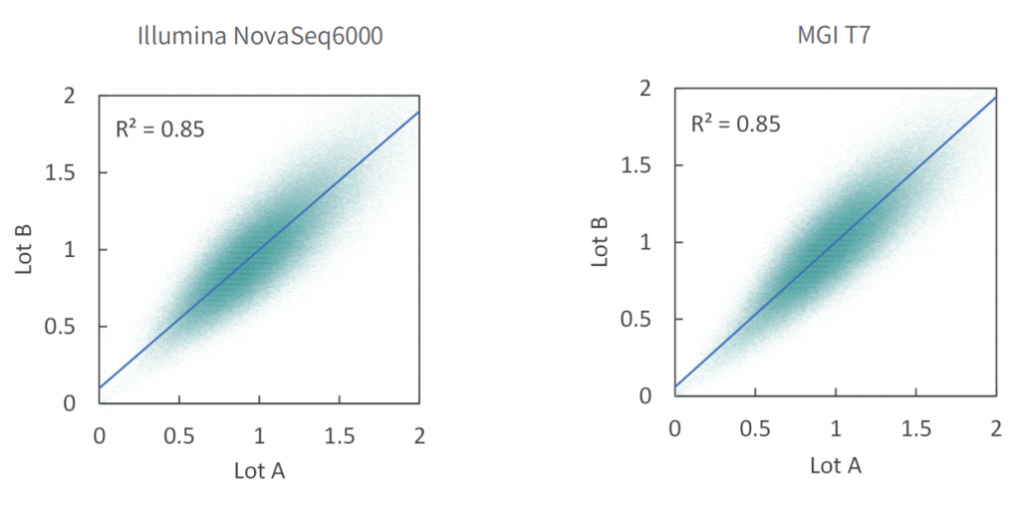
使用不同批次TargetCap® Core Exome Panel v3.0芯片对NA12878 gDNA进行捕获测序,结果显示,不同批次芯片在不同测序平台上均显示出优异的稳定性,不同位点的相对深度相关性高,批次稳定。
变异检测准确
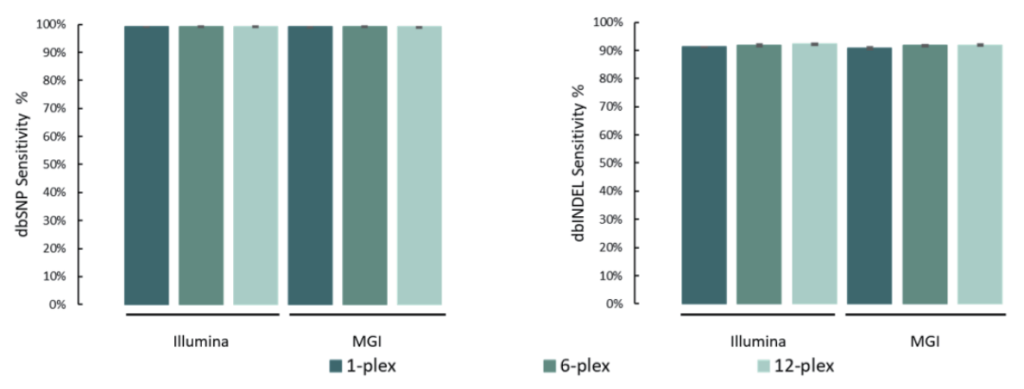
单核苷酸变异(SNV)和插入缺失 (INDEL)是基因组变异的常见形式,也是引起人类疾病的重要原因。
选取NA12878标准品,与预期SNV和INDEL变异进行比较。结果表明,在MGI与Illumina测序平台,SNP灵敏度为99.1%,INDEL灵敏度为91.6%。
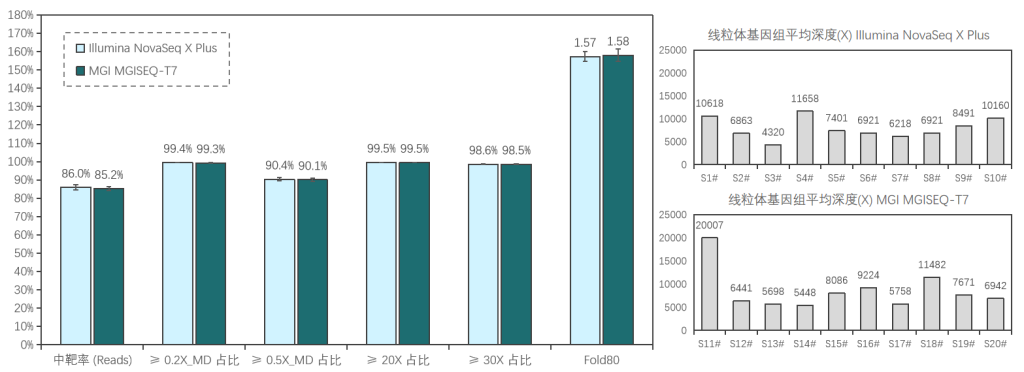
添加线粒体模块临床样本表现
20例全血样本(S1#-S20#),采用1-4 Plex方式使用伯科Core Exome Panel v3.0添加线粒体模块进行过夜杂交捕获;其中,S1#-S10#在Illumina NovaSeq X Plus平台测序, S11#-S20#在MGI MGISEQ-T7平台测序,均采用150PE模式测序。得到测序数据后,抽取8Gb数据进行生信分析。
两种测序平台的数据表现相近,平均深度分别为111x/115x (Illumina/MGI),中靶率优异均> 85%,覆盖均一性极佳(0.2X_MD≥99.3%);仅使用8Gb数据,高达98.5%的捕获区域达到了30X以上,99.5%的捕获区域达到20X以上,为临床样本检测提供了可靠的捕获数据。