潜能不明克隆性造血(CHIP)的致病机制与心脑血管疾病抗炎疗法
- boke
- 2024-01-23
- 5:54 下午
近年来,潜能不明克隆性造血(CHIP)正在被认识到是动脉粥样硬化心脑血管疾病(ASCVD)的一个重要且独立的风险因素,近日,顾东风院士和鲁向锋教授团队的研究成果[1]提供了CHIP作为ASCVD风险因素相关性的重要证据,还为炎症作为CHIP和CAD之间联系的媒介提供了额外的支持。研究发现,在中国人群中,携带炎症相关基因TET2的CHIP变异最高可以使冠心病风险增加达到300%。因此,针对CHIP携带者开展抗炎疗法可能会对该类人群的心脑血管健康产生获益。
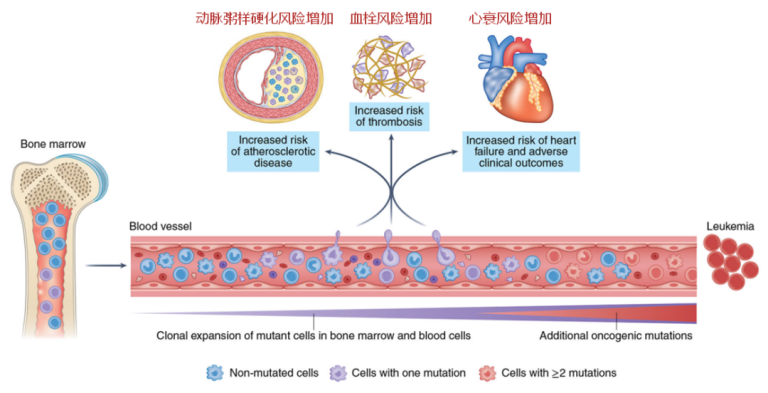
图4. TET2或DNMT3A的基因突变导致动脉粥样硬化机制[4]
CHIP相关基因变异导致心脑血管疾病的机制
CHIP中最常见的突变发生在表观遗传调控因子上,例如,TET2或DNMT3A,因此,该类基因突变更可能导致血细胞基因表达的改变。值得注意的是,这两个基因也是中国人群CHIP发生频率最高的两个基因[1],而TET2 则是高风险基因。从理论上讲,这些基因突变可能通过血小板和白细胞激活来改变血栓风险,或者通过改变免疫细胞功能来影响动脉粥样硬化过程。
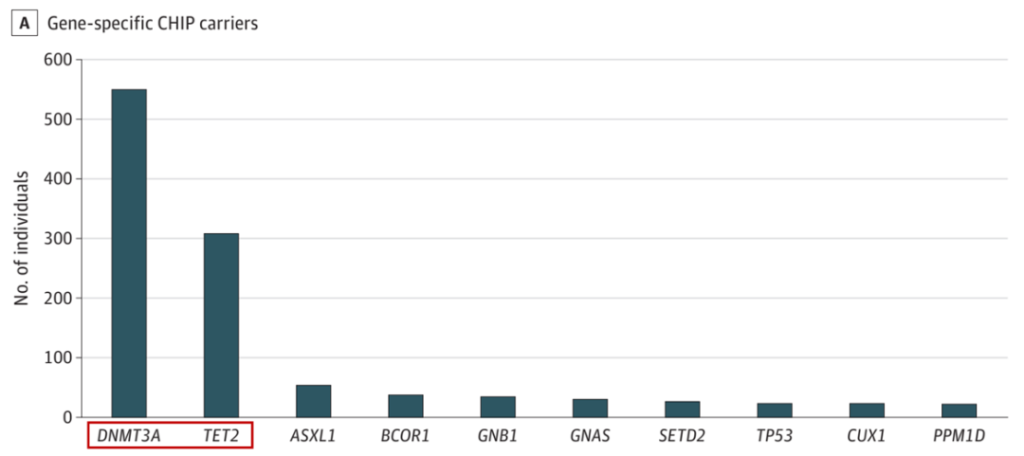
图2.中国人群中的高频CHIP突变基因[1]
动脉粥样硬化伴随着胆固醇在动脉壁的积累,是冠心病的病理基础,属于慢性炎症疾病。因此,那些增加基础炎症或减少胆固醇从病变中流出能力的因素都可能导致动脉粥样硬化恶化。

图3. 动脉粥样硬化的形成。脂质和脂蛋白可以诱导细胞粘附分子(CAM)的内皮表达,介导单核细胞-内皮粘附和单核细胞(Monocyte)迁移到内皮下层。在那里,它们被脂质物质激活,释放促炎细胞因子,分化为巨噬细胞,并通过获得脂质和脂蛋白,发展为泡沫细胞(Foam cell,脂质核心形成关键)。中性粒细胞(Neutrophil)释放胞外诱捕网(NETs),粘附在内皮上并迁移到内皮下层,在那里它们释放活性氧(ROS)、蛋白酶和NETs,从而诱导细胞外基质降解。平滑肌细胞(SMC)分化为表达αSMA的SMC和SMC泡沫细胞。它们还迁移到内膜,同时中性粒细胞产物在内膜诱导SMC凋亡。这些过程导致坏死核心和动脉粥样硬化斑块的形成。[3]
目前的大量研究表明,TET2或DNMT3A的基因突变会导致炎症增加。在小鼠的巨噬细胞和树突细胞中,TET2抑制了促炎症分子的转录,例如IL-6,这是一个已知的促进动脉粥样硬化的介质。其他研究发现,当小鼠的巨噬细胞暴露于LDL或脂多糖时,Tet2的缺失会导致多种炎症介质的表达增加,如IL-1β、IL-6、CXCL1、CXCL2和CXCL3。当发生TET2-CHIP时,炎症介质的表达增加可能会导致更多白细胞被招募到斑块中,引发一个正向反馈恶性循环,导致动脉粥样硬化的加速(图4)。
DNMT3A在调节先天免疫功能方面的作用并不像TET2或JAK2那样确立,但大多数研究都发现,当该基因被干扰时,会有炎症增加的证据,但是这些特定基因表达变化的机制仍然不太清楚。
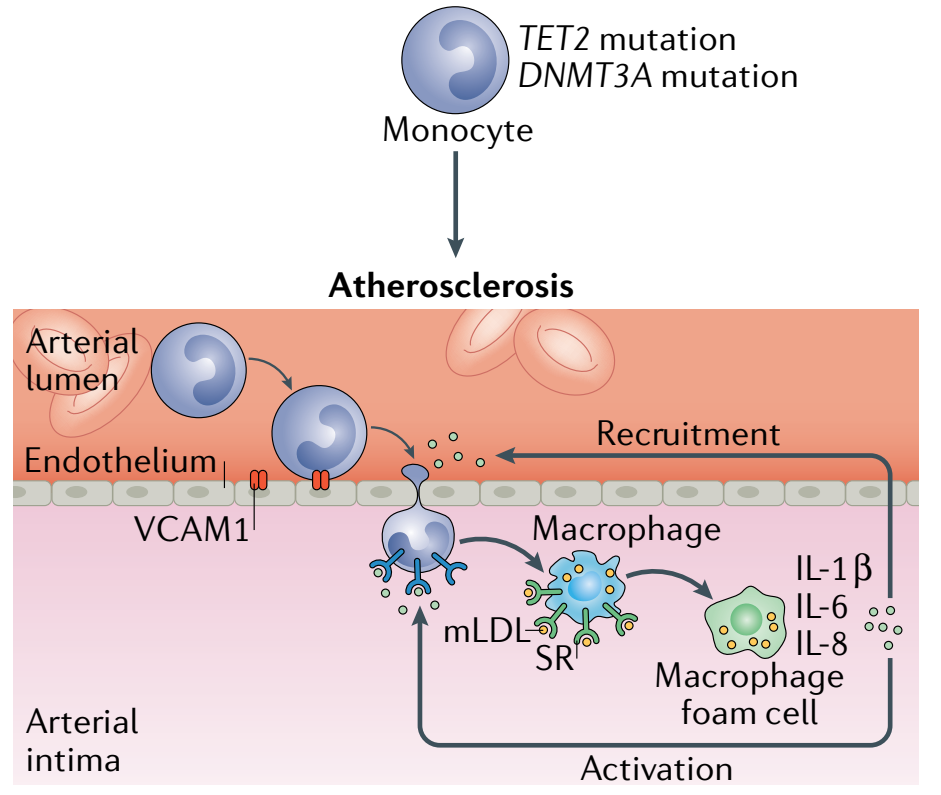
图4. TET2或DNMT3A的基因突变导致动脉粥样硬化机制[4]
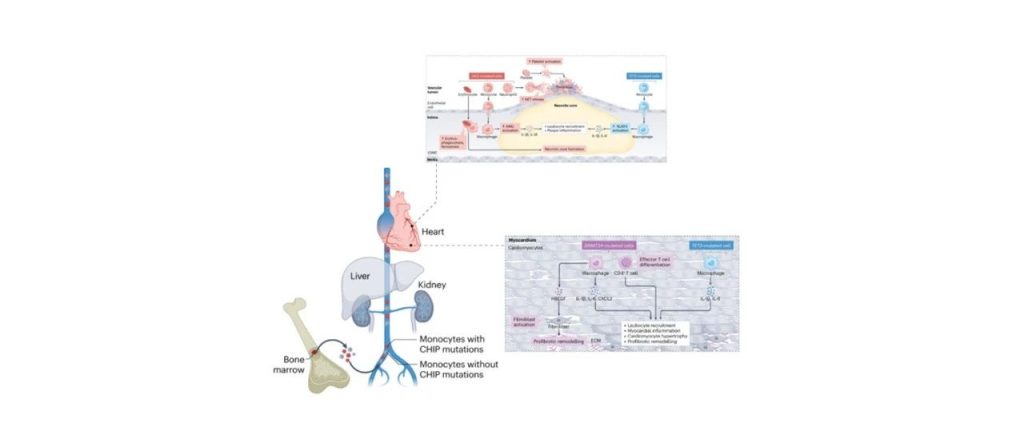
同时,Tet2或Dnmt3a突变在小鼠模型中还对其他心血管表型存在影响。在两个心力衰竭的小鼠模型中,骨髓细胞中Tet2的缺失导致射血分数降低,心脏纤维化和重塑增加。仅限于髓系细胞的Tet2缺失导致了类似的发现,表明巨噬细胞或单核细胞发挥着更重要的作用。在另一项研究中,CRISPR介导的骨髓中Tet2或Dnmt3a的敲除导致了小鼠的心脏肥大和纤维化增加以及血管紧张素II引起心脏功能降低。这些结果表明,人类中携带TET2或DNMT3A突变的影响与心肌中免疫细胞功能改变因果相关(图5)。
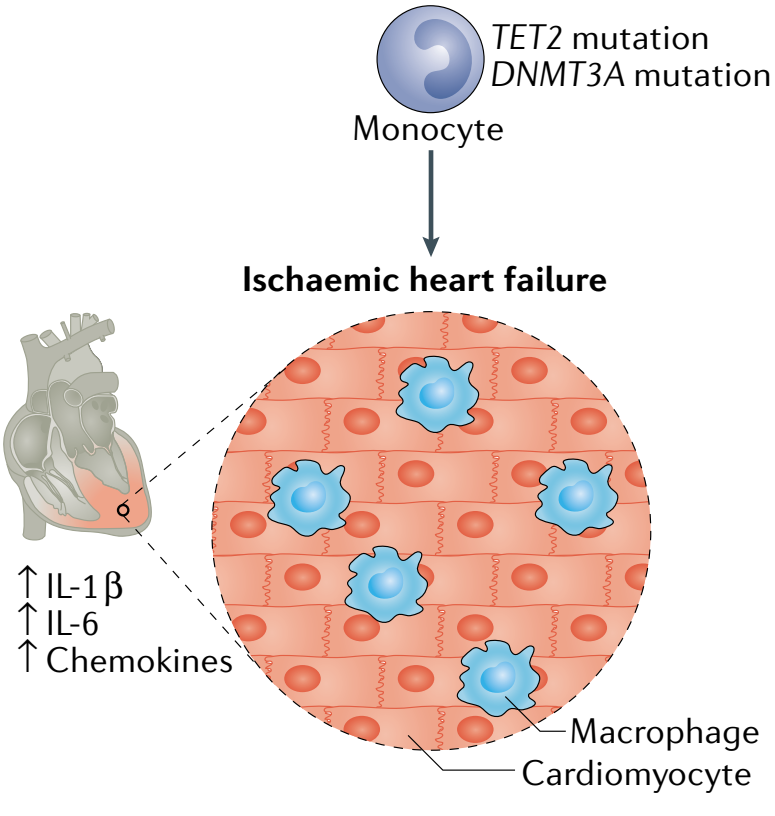
图5. TET2或DNMT3A的基因突变导致心衰机制[4]
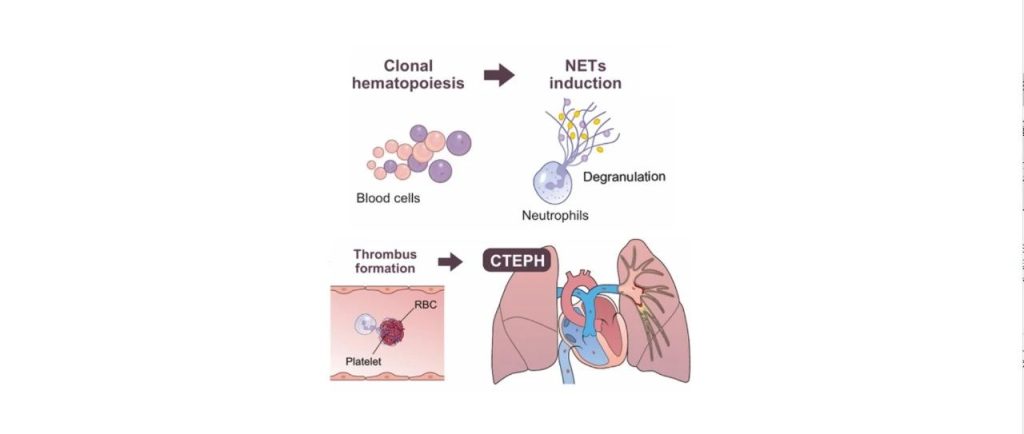
此外,JAK2基因突变还被发现在动脉血栓形成中发挥着作用。携带JAK2-V617F突变的小鼠会形成肺静脉血栓。JAK2基因突变增加血栓形成的机制可能与JAK2-V617F突变导致中性粒细胞胞外诱捕网(NETs)形成水平升高有关(图6)。
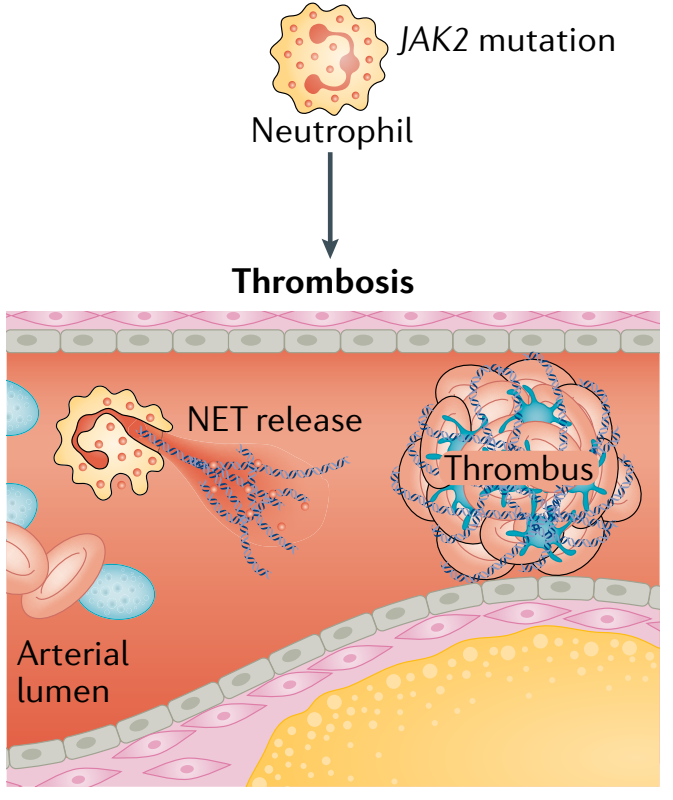
图6. JAK2基因突变导致血栓机制[4]
目前,包括TET2和DNMT3A在内的多个高频CHIP变异基因已经在小鼠模型中被证明与心脑血管疾病高度相关(表1)。

表1. 已报道影响心脑血管疾病的高频CHIP基因[2]
心脑血管疾病抗炎疗法
最近使用抗炎疗法的临床试验,特别是IL-1β抗体或秋水仙碱,已经显示出降低心脑血管疾病的效果。IL-1β抗体使所有炎症小体的主要产物失活,而秋水仙碱则抑制NLRP3炎症小体的组装和炎症因子分泌,并具有其他抗炎活性。这些研究验证了炎症和炎症小体在人类动脉粥样硬化性疾病中的重要性。
抑制不同类型的炎症小体
炎症小体,是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物,是天然免疫系统的重要组成部分。已发现的炎性小体主要有5种,即NLRP1炎性小体、NLRP3炎性小体、NLRC4炎性小体、IPAF炎性小体和AIM2炎性小体。在小鼠CHIP模型中,Tet2缺失激活了NLRP3炎症小体,而JAK2VF激活了AIM2炎症小体。这表明可能需要特定的NLRP3或AIM2炎症小体抑制剂来治疗根据CH状态的CHIP相关CVD。正在开发多种NLRP3抑制剂,使用NLRP3抑制剂CRID3治疗类风湿性关节炎的临床试验因为肝毒性而停止。AIM2炎症小体抑制剂已被报道在Apoe−/−小鼠中增加斑块稳定性的特征;这种抑制剂是否直接靶向炎症小体可以减少CVD风险而不增加感染,仍有待确定。
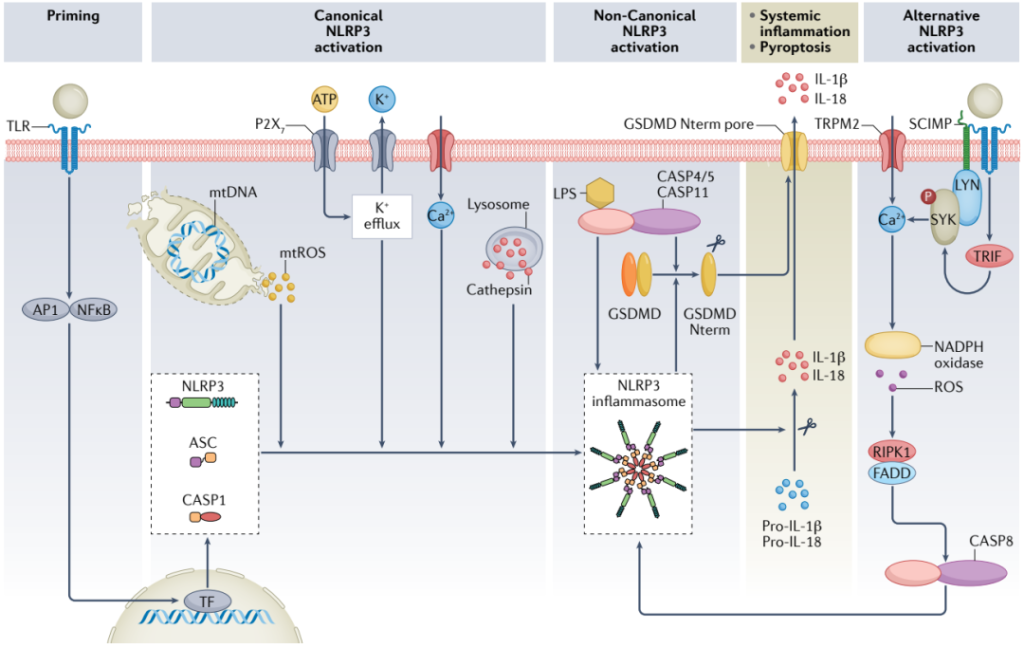
图7. 炎症小体NLPR3激活的信号通路[3]
抑制炎症小体下游途径
与CHIP促进的动脉粥样硬化相关的NLRP3和AIM2炎症小体激活导致活性IL-1β和IL-18的分泌。在TET2-CHIP中,血浆IL-1β增加,而在JAK2VF-CHIP中,IL-18增加。卡那单抗抗炎性血栓形成 (CANTOS) 临床试验表明,抑制IL-1β可显著降低心血管疾病风险, 这项研究首次为抗炎疗法降低冠状动脉疾病风险提供了临床试验证据(图8)。卡那单抗是一种IL-1β阻断抗体,用于CANTOS研究中治疗先前患有冠状动脉疾病和血浆C-反应蛋白水平升高的患者,然而需要注意该疗法也导致了患者感染的增加。考虑到CANTOS临床试验的积极结果,以及上述临床前研究结果,IL-1β拮抗似乎是针对TET2和JAK2VF-CHIP相关CVD的合理首选。
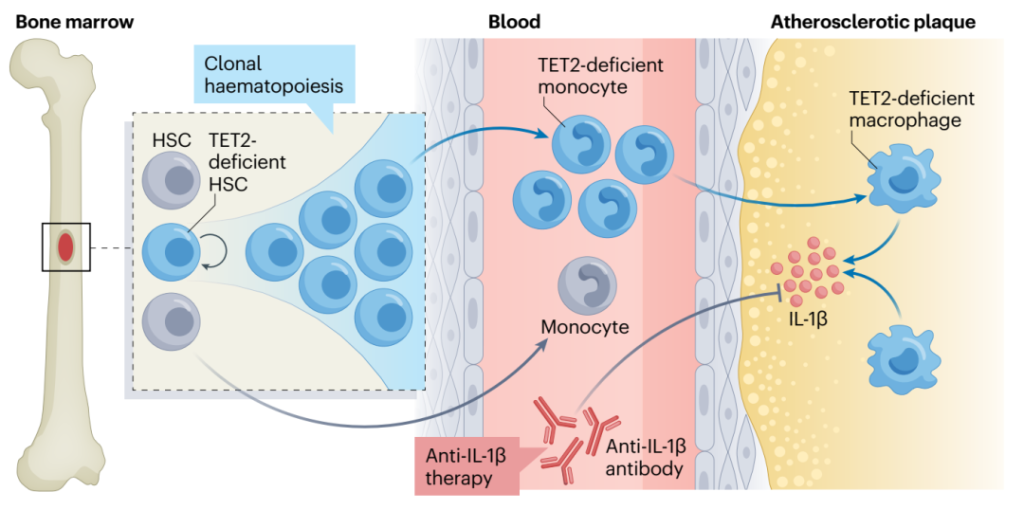
图8. TET2-CHIP介导炎症反应导致心脑血管疾病的机制以及卡那单抗抗炎疗法原理[5]
IL-18在T细胞和自然杀伤细胞产生IFNγ方面起着主要作用,并通过释放IFNγ和其他机制增加小鼠中的动脉粥样硬化。IFNγ具有强烈的促动脉粥样硬化作用,并在JAK2VF介导的动脉粥样硬化中通过上调AIM2起特定作用。因此,CHIP相关动脉粥样硬化的IL-18抑制的治疗潜力值得进一步探索。
炎症小体激活后,其下游的IL-6水平可能升高;同时,与CVD相关的高频CHIP基因(TET2、DNMT3A和ASXL1)变异中,IL-1和IL-6水平中度增加。同时,与TET2-和DNMT3A-CHIP相关的增加CVD风险被IL-6R的D358A变体所抵消,表明IL-6在CHIP携带人群的CVD发生中的关键作用。
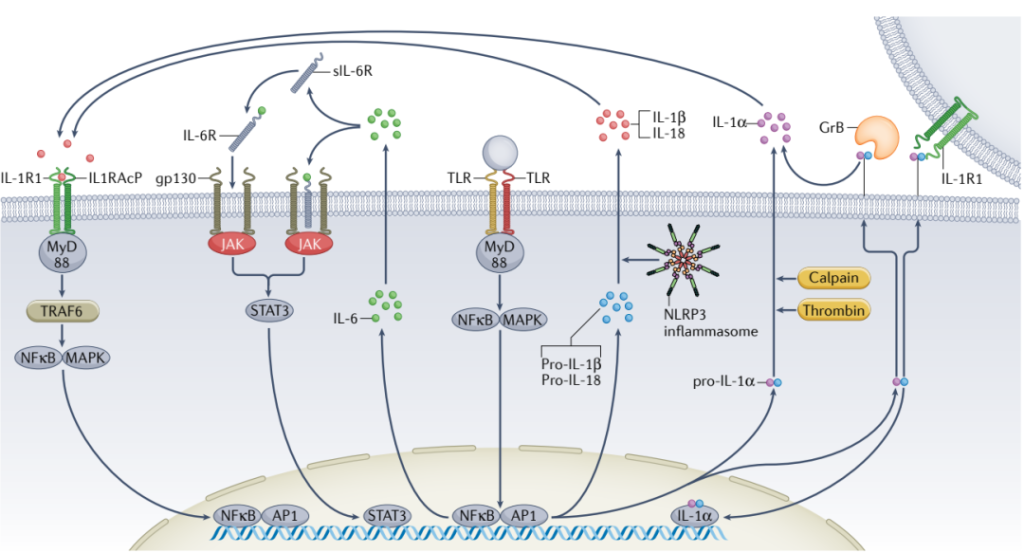
图9. 细胞因子IL-1α、IL -1β与IL-6的细胞信号通路[3]
慢性肾病是动脉粥样硬化性疾病的高危因素,IL-6拮抗剂ziltivekimab是正在为慢性肾病相关的动脉粥样硬化性疾病开发的抗炎疗法,并且在RESCUE二期临床试验中发现可以降低炎症和血栓形成的生物标志物,然而,这似乎伴随着APOB水平的增加以及脂蛋白(a)水平的降低 (图10)。使用IL-6单抗tocilizumab(托珠单抗)治疗类风湿性关节炎的一个并发症也是血脂水平的异常,包括甘油三酯、非高密度脂蛋白胆固醇和APOB的水平。因此,对于CHIP相关CVD,有必要进一步评估IL-6拮抗剂与严格控制脂蛋白水平相结合的潜在治疗方案。
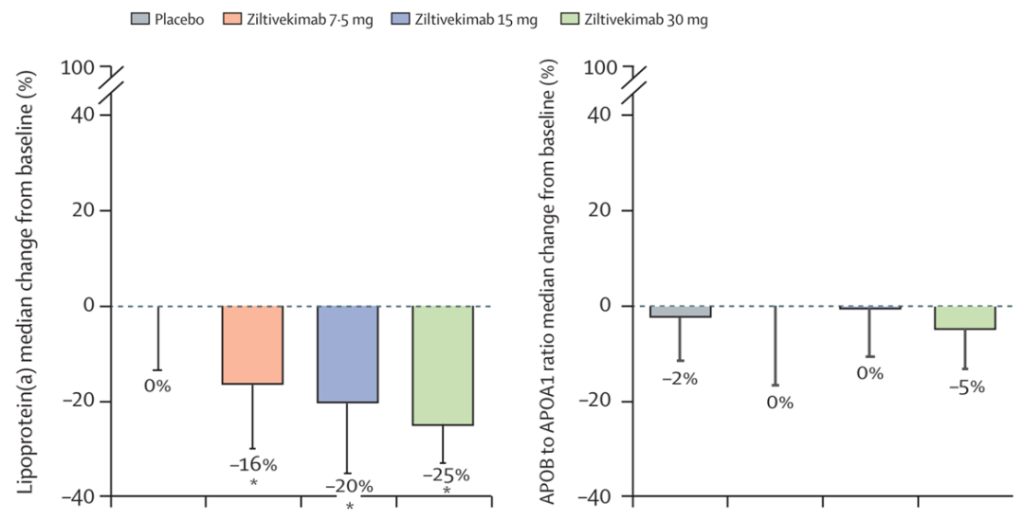
图10. IL-6拮抗剂ziltivekimab治疗引起脂蛋白水平变化[6]
CHIP突变特异性疗法
维生素C代谢物可以激活TET2,并可以在小鼠中通过增加5-羟甲基胞嘧啶的形成来恢复TET2缺陷,从而逆转造血干细胞的更新异常,这代表了一种对于TET2-CHIP携带者潜在的预防性治疗以预防CVD。
JAK2VF虽然不如TET2和DNMT3A变体常见,但它具有重要的属性,使其成为降低CVD的有吸引力的治疗靶标。JAK2VF比其他CHIP变体显著增加静脉和动脉血栓性疾病以及动脉粥样硬化,并可能在较低的等位基因频率下增加疾病,而且呈现年轻化。
JAK2VF可以通过多种抑制方法进行干预,Ruxolitinib是JAK1和JAK2两个激酶的抑制剂,使用Ruxolitinib治疗减少了异常的NET形成和深静脉血栓形成。但Ruxolitinib在JAK2VF小鼠和人类中导致LDL胆固醇的显著增加。此外,使用JAK激酶抑制剂baricitinib、tofacitinib和upadacitinib治疗关节炎或溃疡性结肠炎的人可能增加血栓和CAD的风险,这表明可能需要更特异的靶向JAK2或JAK2VF。此外,为了减少动脉粥样硬化性风险,携带JAK2VF的人可能会从更有效的抗血栓治疗中受益,例如使用阿司匹林多剂量给药或尝试特异的JAK2抑制剂。
展望
最近汇集的证据进一步证实了CHIP通过增加斑块炎症和炎症体激活促进动脉粥样硬化的致病机制以及抗炎疗法在治疗动脉粥样硬化性CVD中的有效性,这为心脑血管疾病的预防与治疗提拱了一个重要的方向。采用针对性靶向CHIP特异基因突变,可能会进一步让CHIP携带个体在抗炎治疗的风险/获益比提高。可以考虑多种潜在的治疗方法,例如靶向炎症的下游通路因子,如IL-1β或IL-6,以及CHIP突变特异性疗法。
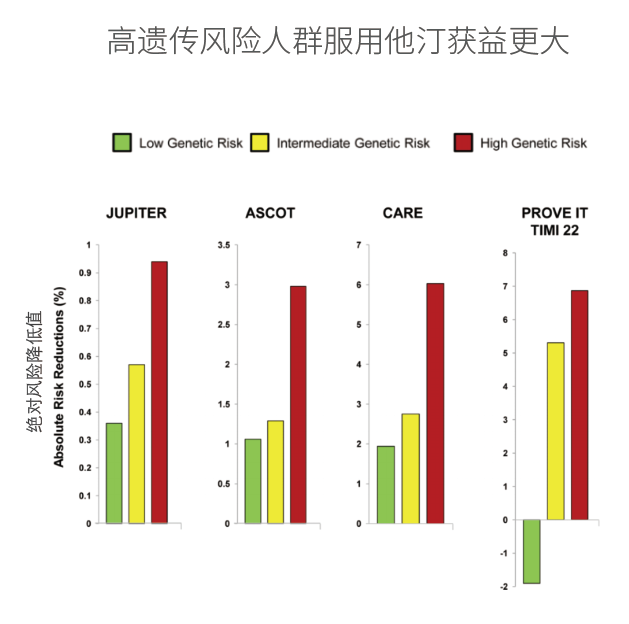
在将来,临床试验设计还需要使用综合遗传风险评估工具,对高先天遗传风险和高CHIP基因变异风险的人群进行分组,因为他们可能从抗炎疗法中获益最大,用以更精确的验证这些疗法的有效性和安全性。
参考资料
1. Zhao K, Shen X, Liu H, et al. Somatic and Germline Variants and Coronary Heart Disease in a Chinese Population[J]. JAMA cardiology, 2024.
2. Tall AR, Fuster JJ. Clonal hematopoiesis in cardiovascular disease and therapeutic implications. Nat Cardiovasc Res. 2022 Feb;1(2):116-124.
3. Speer, T., Dimmeler, S., Schunk, S.J. et al. Targeting innate immunity-driven inflammation in CKD and cardiovascular disease. Nat Rev Nephrol 18, 762–778 (2022).
4. Jaiswal S, Libby P. Clonal haematopoiesis: connecting ageing and inflammation in cardiovascular disease[J]. Nature Reviews Cardiology, 2020, 17(3): 137-144.
5. Ahmad H, Jaiswal S. Clonal haematopoiesis and atherosclerotic cardiovascular disease[J]. Nature Reviews Cardiology, 2023: 1-2.
6. Ridker PM, Devalaraja M, Baeres FMM, Engelmann MDM, Hovingh GK, Ivkovic M, Lo L, Kling D, Pergola P, Raj D, Libby P, Davidson M; RESCUE Investigators. IL-6 inhibition with ziltivekimab in patients at high atherosclerotic risk (RESCUE): a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet. 2021 May 29;397(10289):2060-2069.
推荐阅读