新抗原癌症疫苗+免疫检查点抑制剂+MRD检测,前沿科技联合阻击癌症
- boke
- 2022-12-29
- 7:07 上午
2022年8月,哈佛医学院的科研团队合作在Cancer Cell杂志上发表了题为“Personalized neoantigen vaccine NEO-PV-01 with chemotherapy and anti-PD-1 as first-line treatment for non-squamous non-small cell lung cancer”的研究论文。该研究报道了首个将个体化新抗原癌症疫苗NEOPV-01与化疗和免疫检查点抑制剂(ICI)抗PD-1单抗联合,用于治疗NSCLC的1b期临床试验结果,并首次将高精度ctDNA-MRD检测方法用于新抗原癌症疫苗疗效的评估。该研究结果表明接受联合治疗后,患者均无明显的不良症状;并且全程接受联合治疗方案患者的体内,可以明显观察到具有免疫效应的CD4+T细胞和CD8+T细胞的产生,患者的肿瘤大小也得到了有效控制。临床实验数据很好地支持了联合治疗方案在晚期非鳞状非小细胞肺癌治疗中的安全性和有效性。
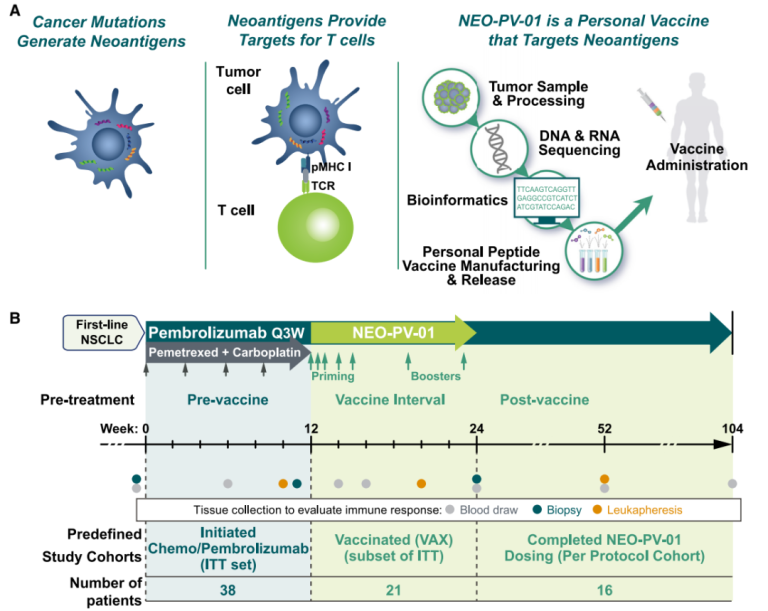
图1 临床研究设计和治疗方案
肿瘤细胞通过各种方式逃脱机体免疫系统的“监控”,肿瘤免疫治疗旨在通过重新启动并维持肿瘤免疫循环(图1),恢复机体正常的抗肿瘤免疫反应,从而达到控制与清除肿瘤的目的。该研究使用的联合疗法包括化疗、新抗原癌症疫苗NEOPV-01和抗PD-1单抗,它们可以作用于肿瘤免疫循环的始末端,包括第1、第2和第7环节:环节1)化疗能引起使肿瘤细胞死亡并释放抗原,从而激活免疫反应;环节2)NEOPV-01疗法则是人工制造肿瘤细胞特异性抗原,并递呈给免疫细胞来激活免疫反应;环节7)抗PD-1单抗用于解除肿瘤细胞上的“伪装”,恢复T细胞对肿瘤细胞的杀伤。这样一来,通过联合疗法让肿瘤免疫循环正常运作起来,充分发挥新抗原癌症疫苗NEOPV-01的作用。
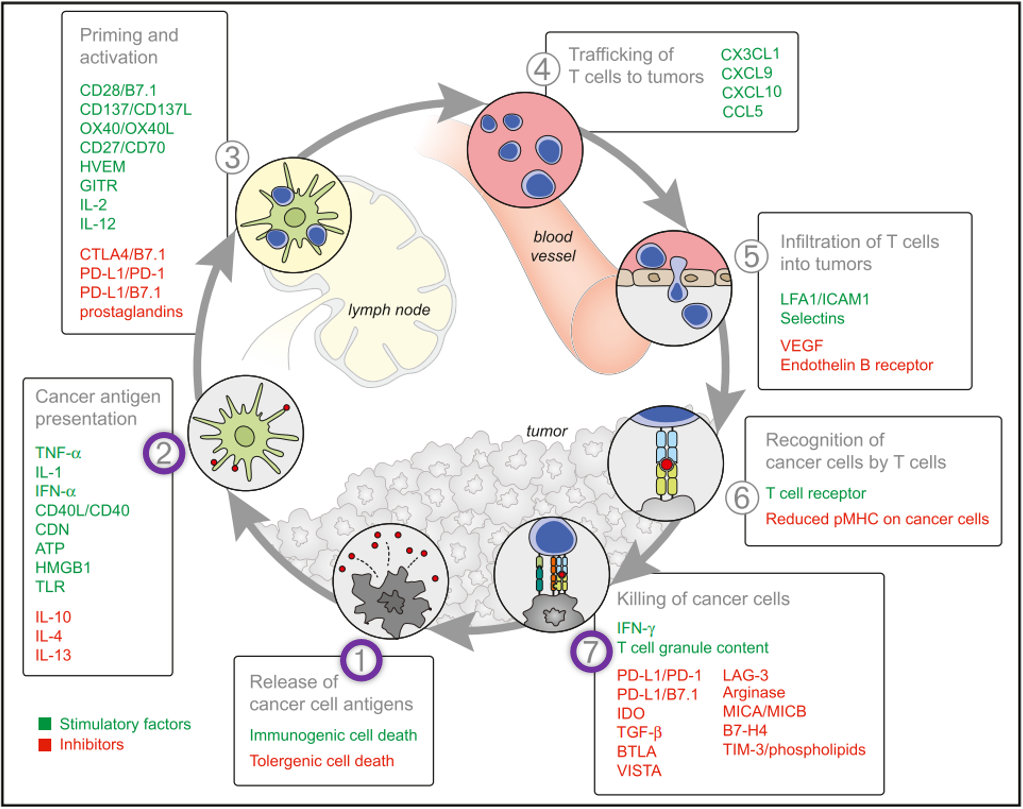
图2 肿瘤免疫循环包括7个环节:1)肿瘤细胞抗原释放;2)肿瘤抗原呈递;3)T细胞激活;4)T细胞向肿瘤组织迁移;5)肿瘤组织T细胞浸润;6)T细胞识别肿瘤细胞;7)清除肿瘤细胞。
新抗原癌症疫苗根据每位患者的肿瘤基因组变异设计个性化疫苗,制备流程包括肿瘤DNA/RNA配对测序→生物信息学计算→个性化疫苗的确定及生产。在该研究中,每位患者的NEO-PV-01疫苗包含20种肿瘤新抗原(14-35个氨基酸的多肽),并配合免疫佐剂poly-ICLC使用。
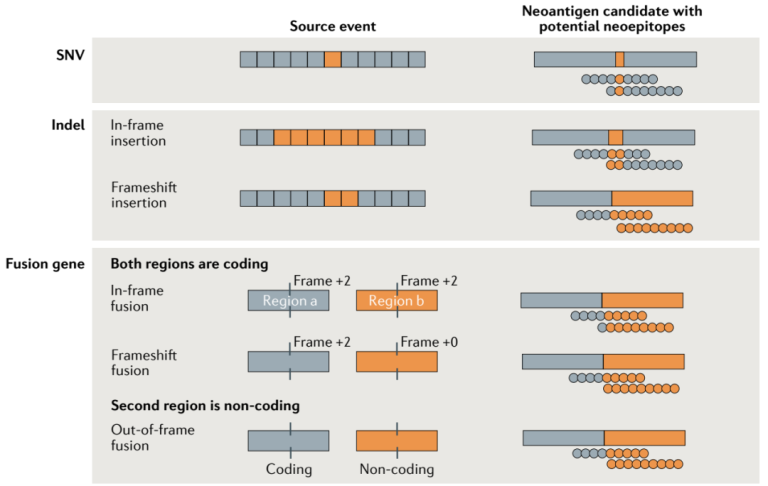
图3 根据肿瘤基因组体细胞变异筛选肿瘤新抗原
该研究从2018年5月到2019年4月共入组38例患者,最终16例患者完成了全程疫苗接种,5名因疫苗接种期间疾病进展而停止治疗。至少接受一剂NEO-PV-01疫苗注射的21位患者的病灶均明显减小,其中两名患者在Post-Vaccination后肿瘤大小进一步减小超过30%。
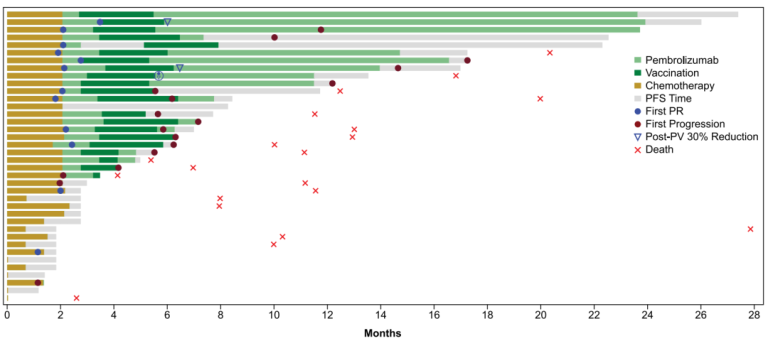
图4 该临床研究的Swimmer图
外周血血浆中循环肿瘤DNA(ctDNA)的丰度可以反映肿瘤的总体负荷,并预测癌症的复发和治疗反应,大量研究表明,ctDNA-MRD比常规检测手段更加灵敏。因此,研究人员首次引入了基于ctDNA的MRD检测技术来验证联合疗法的效果。
该研究采用的ctDNA-MRD技术是基于多重PCR方法的Tumor-informed ctDNA assays,有意思的是,在原技术流程追踪16个患者特异的肿瘤体细胞变异(Signatera Pool)的基础上,还加入了至少16个与新抗原来源一致的变异位点(Neon/BioNTechPool)。在既往研究中,化疗联合抗PD1单抗治疗的无进展生存期(PFS)中位值为8.8个月,因此,研究人员采用PFS-9(无进展生存期达到9个月)来评估新疗法的治疗效果。总体而言,以PFS-9为划分,在达到PFS-9的每位患者中(9名),几乎检测不到携带新抗原变异位点ctDNA分子,相反,未达到PFS-9(no PFS-9,8名)的患者均显示稳定或升高(图5E),图5F和5G给出了达到PFS-9(2L5)和no PFS-9(2L3)患者的血浆中新抗原变异位点ctDNA分子含量变化的一个案例。上述结果表明,ctDNA-MRD检测方法在新抗原癌症疫苗治疗中可以对疗效进行有效评估。
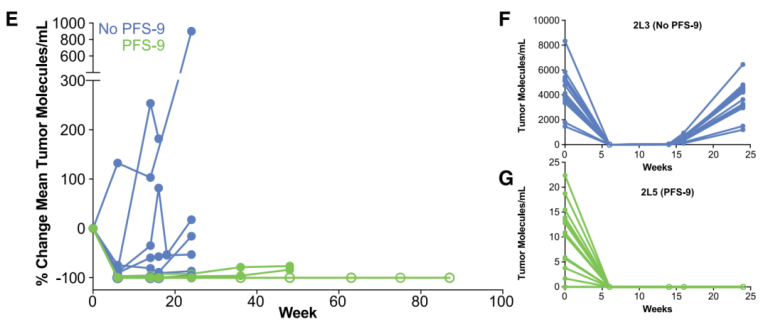
图5 ctDNA-MRD检测结果(新抗原变异位点ctDNA分子)
在这项针对非鳞NSCLC的I期临床研究中,研究者探索了靶向新抗原的联合治疗策略,发现NEO-PV-01联合Pembrolizumab和化疗的方案是安全可靠的。由于疾病进展、活检中肿瘤含量低而无法生产疫苗或因突变不足导致高质量新抗原数量低,~ 45%的入组患者无法进行疫苗接种。研究人员认为,选择制备更为快捷的mRNA疫苗、通过液体活检(ctDNA)获取新抗原信息,可能是解决上述问题的可行方案。此外,该研究是单臂设计,无法独立评估新抗原癌症疫苗治疗的作用,可以通过比较新抗原癌症疫苗联合anti-PD-1+化疗与anti-PD-1+化疗的治疗方案,进一步开展随机队列研究。未来,基于肿瘤新抗原癌症疫苗的联合疗法将为癌症患者带来更大的希望。
伯科生物自主开发的SynStar21多功能Oligo合成仪,硬件和软件系统可以满足从科学试验到药物研发等不同DNA和RNA序列的合成需求。伯科TargetCap®基因靶向捕获技术已率先实现全面国产化,具有高性能、短周期优势,适合不同组学的研究与转化;针对MRD研究,伯科生物可以提供变异筛选的全外显子Panel和不同大小的高品质固定Panel,也可以快速定制、合成个体化变异位点Panel,供货周期<7天。
查看链接:
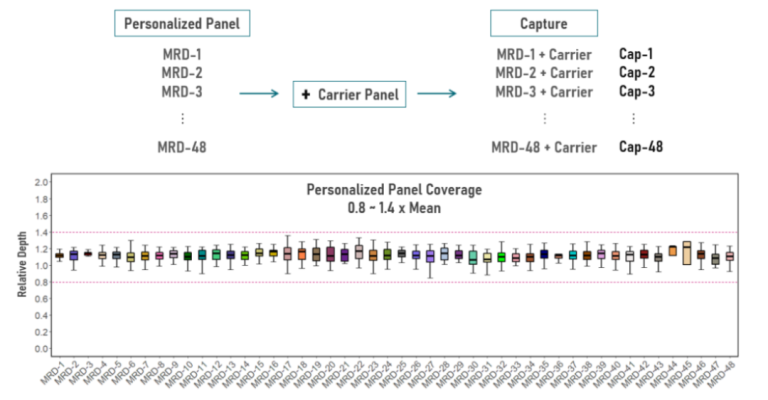
伯科设计合成的48个个体化位点Panel(MRD-1 ~ MRD-48)分别掺入Carrier Panel中,进行48个捕获实验;其中,每个个体化位点Panel覆盖的位点数量小于150个。对每个位点的相对覆盖深度(位点深度/整体Panel平均深度)进行统计,在48个Panel中,所有位点的相对覆盖深度在0.8-1.4x Mean Depth之间,表现优异。


