单链建库与靶向捕获技术助力aDNA研究
- boke
- 2022-10-13
- 7:21 上午
2022年诺贝尔生理学或医学奖授予瑞典古生物学家斯万特·帕博(Svante Pääbo),以表彰他在已灭绝的人类基因组和人类进化方面的发现。斯万特·帕博教授开创性研究产生了一门全新的科学学科;古基因组学。通过揭示区分所有活着的人和灭绝的古人类的基因差异,为探索与研究现在人类的独特之处奠定了基础。
自2010年以来,大量的古人类基因组数据迅速积累。超过6000个古人类基因组重建使我们能够对古人类种群的迁移、相互作用、扩张和消失进行详细的了解。一个重要里程碑是在古DNA (aDNA)领域引入二代测序(NGS)技术,NGS相关技术在古人类遗骸上的应用不仅大大提高了数据通量,还减少了现代DNA的影响。古DNA (aDNA)技术取得了显著进步,使大规模的aDNA研究成为可能[1]。
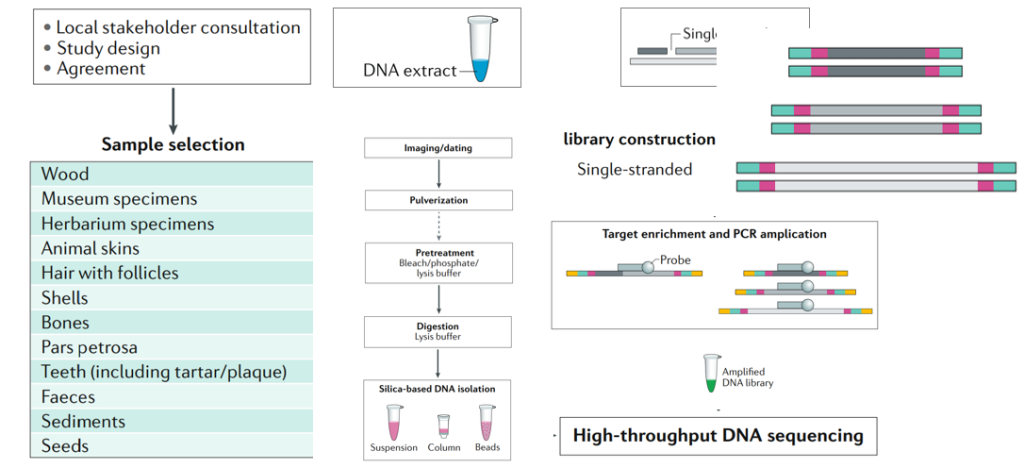
图1 aDNA研究部分实验流程[2]
单链建库技术
aDNA降解严重,片段短,而且存在Nick和Gap等大量损伤,常规的磁珠纯化不利于段片段回收,同时双链建库的文库转化效率较低,因此,需要更为有效的建库方法。单链建库可以充分利用断裂的单链DNA片段,对数据利用率的改善立竿见影。
从单链-单链的直接连接(Thermostable RNA Ligase),到随机碱基或延伸末端(TdT)的“锚定”连接(T4 DNA ligase),“酶学连接”单链建库方法已经获得长足的进步。有意思的是,在单链建库技术中,我们也可以看到新晋诺奖“单击化学”的身影,通过TdT在单链3’端添加G-N3,与带有炔烃修饰的接头进行“单击连接”,代替酶学连接[3]。值得一提的是,单链建库对于降解的DNA具有普遍适用性,例如亚硫酸氢盐处理的DNA(肿瘤早筛DNA甲基化标志物研究),FFPE样本(肿瘤用药伴随诊断)等。
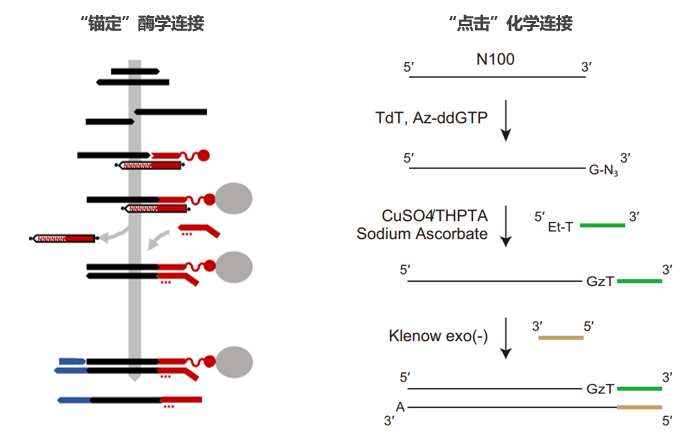
图2 酶学法和TdT介导的化学法单链建库技术[3、4]
DNA捕获技术
通常情况下,古DNA序列常常只占测序数据的1%不到,因此将鸟枪法测序应用于大量样本,恢复用来进行基因组间比较的所需的特定区域是不切实际的。一种解决方案是使用“DNA捕获”,利用DNA或RNA寡核苷酸“探针”与靶向序列杂交,从样本中富集特定基因组区域。
DNA捕获技术也被称为为液相基因芯片技术(Genel Panel,靶向捕获测序),已经发展10余年时间,按照制备方法分为直接合成与间接制备两种,且都属于化学合成,Genel Panel的合成路线决定了Gene Panel的性能。间接制备中,双链DNA探针需要二次扩增,间接制备生物素修饰探针,存在探针拷贝数均一性偏好的隐患;RNA探针需要进行扩增和体外转录,也存在探针拷贝数均一性偏好性,此外,其序列依赖的随机生物素修饰方式对覆盖均一性也有影响。因此,直接合成的Gene Panel具有更优异的靶向捕获性能。
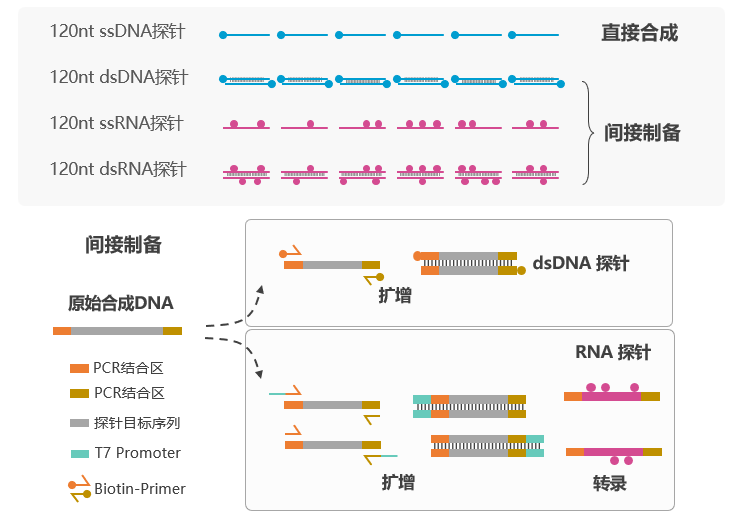
图3 Gene Panel制备的技术路径
DNA捕获技术的应用增加了aDNA研究的规模,扩展了古人类基因组覆盖的时间和地理范围。例如,非洲和东亚南部地区对了解人类人口历史十分重要,但温度或湿度不利于aDNA保存,通过DNA捕获技术可以成功恢复古人类基因组数据。最近的古代非洲人数据揭示了现代人类在非洲大陆的分布、古代东亚人基因组揭示了生活在东亚南部和东南亚的人口之间的相互作用,结果比使用现代基因组或考古数据推断的更复杂。
最近,古DNA研究人员进一步挑战极限,他们脱离化石的桎梏,直接从“土”(沉积物)里提取古DNA。这项技术已成功应用在丹尼索瓦洞和白石崖溶洞中,成功获取了数万年前的古老型人类的DNA。
未来的探索与研究
在古人类研究和古人类基因组不断增加的帮助下,几个功能重要的单倍型涉及先天免疫、脂类代谢、高海拔适应和皮肤色素异常,以及最近发现的决定COVID-19的易感性的单倍型,都已被证明是从古人类继承的。在未来,可以通过构建动物模型并结合基因编辑技术对这些发现进行验证。结合古DNA技术与现代前沿分子生物学技术,我们将能更清晰地理解演化史对当今人类健康的影响。
伯科TargetCap®液相基因芯片技术采用直接合成法,是国内唯一100%全流程国产化基因捕获平台,适用于多物种、多组学以及不同测序平台(二代/三代测序)的基因靶向测序研究。伯科生物依托合成生物学底层技术已经为国内外100多家的医学检验机构、30多家知名医院与临床学术团队开发了400多款液相基因芯片(Gene Panel),在基因组、转录组、甲基化组及病原体液相基因芯片均有成熟的产品。
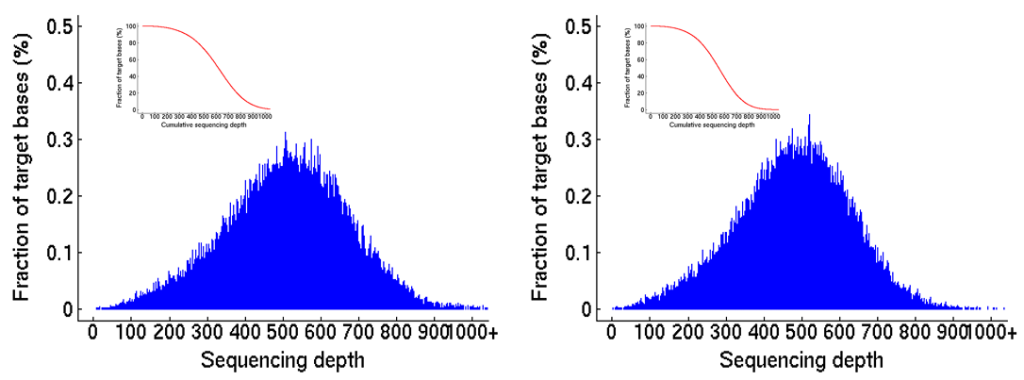
图4 伯科SNP(50,000+)液相基因芯片覆盖均一性表现





