Nature 综述为引,整合DNA/RNA-Cap技术,优化肺癌罕见融合亚型检测
- boke
- 2023-03-07
- 7:07 上午
近日,在《Nature Reviews Clinical Oncology》上,纪念斯隆-凯特琳癌症中心(MSKCC)等研究团队综述了各种罕见分子亚型肺癌的分子特征、诊治和新药研发现状[1]。对于靶向治疗效果更好的融合变异的检测,研究团队提出了组织检测为主,液体活检辅助、依次开展DNA靶向测序、RNA靶向测序以及全基因组/全转录组测序的分子分型检测策略。
在非小细胞肺癌中,致癌基因突变发生频率<5% 被定义为“罕见”,包括EGFR ex20ins 、BRAF V600E、ROS1 fusion等都是罕见突变。虽然“罕见”,但由于全球肺癌患者的基数十分庞大,这类罕见分子亚型肺癌可能对应着大量的患者,某些亚型可能每年影响全球近十万人。
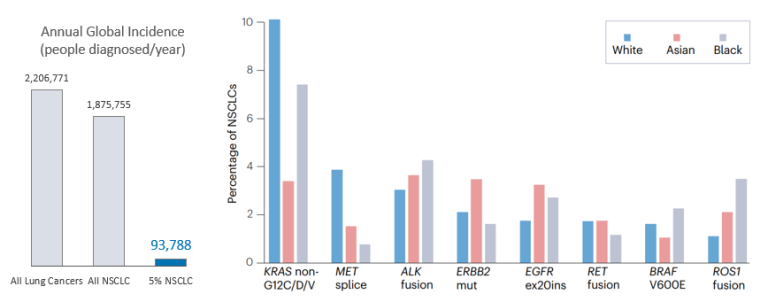
图1 罕见分子亚型肺癌并不“罕见”[1]
肺癌罕见分子亚型存在复杂的多样性,从分子变异特征分类包括突变、融合和拷贝数变化。其中,突变和融合亚型均可按照基因功能进行分类,主要包括涉及编码受体酪氨酸激酶 (RTK) 基因(ALK、RET、ROS1等,RTK配体基因NRG1),以及MAPK信号通路相关基因(KRAS、BRAF)。

图2 罕见融合亚型按照基因功能分类[1]
在靶向治疗方面,突变和融合分子亚型的治疗效果差异较大,融合亚型的治疗效果往往更优,客观缓解率(ORR)普遍超过60%,无进展生存期(PFS)范围则在9-35个月,而突变亚型的ORR普遍低于50%,PFS不超过12个月。因此,精准的分子分型对于临床治疗尤为重要。

表1 靶向治疗对肺癌罕见融合亚型的治疗效果[1]
NGS技术的应用已经改变了肺癌罕见分子亚型的检测模式,肿瘤基因大Panel可以一次覆盖数百个基因,较传统方法更加全面高效,极大的提高了罕见基因变异的检出。基于液相基因芯片的靶向DNA检测是分子分型的主流技术之一,尽管如此,该方法对融合变异的检测灵敏度取决于基因序列以及变异特点。例如,ROS1内含子31存在重复序列,较难设计探针以及比对,而NRG的内含子又过大较难取舍。
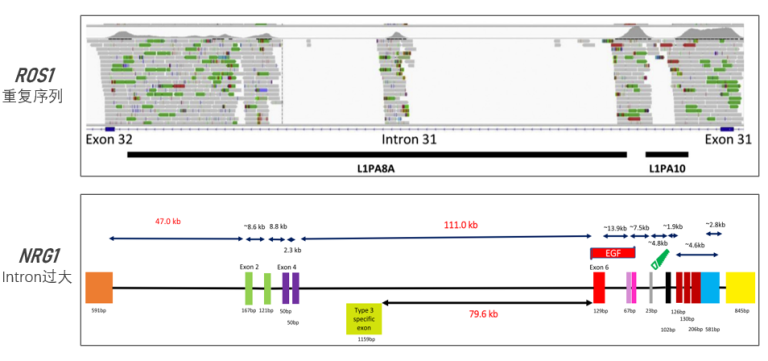
图3 DNA层面检测融合的主要难点[2、3]
对于可变剪接位的检测(基因内部“融合”),捕获富集可能较扩增子更加稳定,探针可以一定程度上耐受序列变异,而短链引物则会受到更大的影响。但DNA测序的内在局限性仍在,对于METex14 Skipping,如果14号外显子的侧翼内含子没有足够覆盖,在内含子深处的缺失或剪接位点突变可能会被遗漏,但即使发现内含子变异,也很难确认其对转录本的影响。
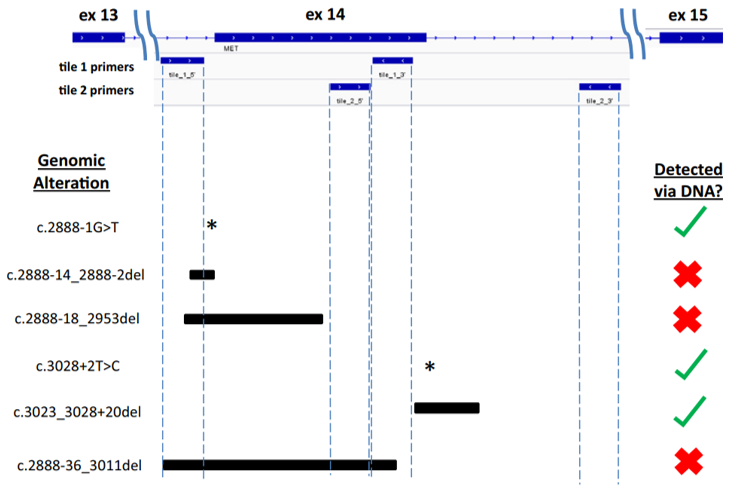
图4 内含子区域变异对DNA层面检测具有挑战性[4]
基于RNA的检测可以直接针对转录本,避免基因组层面的干扰,从而实现更有效和更灵敏的检测;此外,RNA检测还可以对DNA发现的未知意义的融合变异在转录本层面进行验证,已确认其表达情况,优化检测特异性。因此,通过RNA检测融合变异具有更高的灵敏度与特异性。
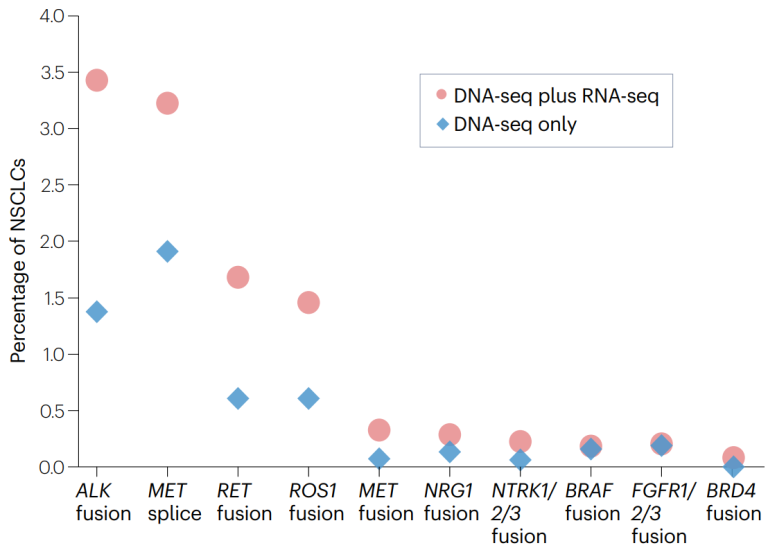
图5 RNA检测有利于罕见融合变异的发现[1]
尽管如此,与DNA相比,RNA更加不稳定,易于降解,导致临床测试失败率较高(10-30%)。优化RNA检测包括优先选择肿瘤含量丰富的样本,避免较旧存档样本的使用等。合理运用DNA和RNA靶向技术可以使之最大限度的发挥各自的优势。目前,整合基于DNA和RNA的测序工作流程的共识方法尚未建立,研究团队提出了一种更具成本效益的策略。如图6所示,使用基于组织样本的DNA 靶向NGS作为初步筛选试验,考虑到活检取样的成功率,基于ctDNA的液体活检作为补充,随后在选定的患者中使用基于RNA的靶向NGS检测(例如在DNA测试阴性,和/或具有未知意义的融合或内含子突变的患者),该策略侧重于解决基于DNA测试的局限性,并以更经济的方式使用RNA测试,但检测周期会更长一些。对于仍然阴性患者,全基因组/全转录组(WGS/WTS)测序技术可进一步探索可能的罕见基因变异。

图6 肺癌分子分型策略[1]
伯科拥有完全自主的DNA/RNA-Cap液相基因芯片靶向检测技术,针对RNA-Cap Panel的质量验证,采用RNA/DNA样本平行捕获评估,能够更准确的辨别基因表达和剪接差异与Panel(探针)性能的影响,特别是在不依赖阳性标准品的前提下,RNA/DNA样本平行捕获验证可以为融合热点基因或相关区域的捕获性能保驾护航。
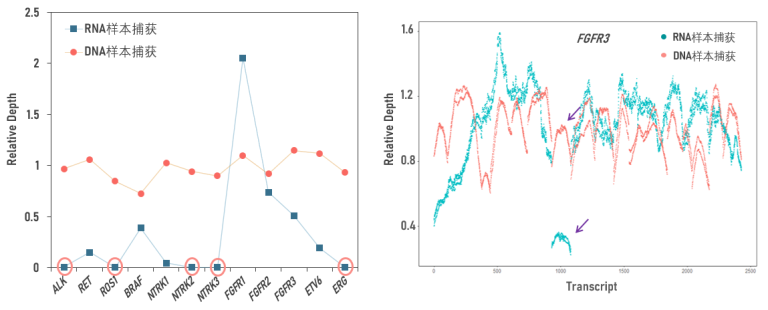
图7 伯科RNA-Cap Panel通过DNA&RNA平行验证